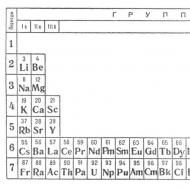
Sifat unsur mengikut jadual berkala. Jadual berkala unsur kimia. Sifat-sifat jasad ringkas, serta bentuk dan sifat sebatian unsur, secara berkala bergantung pada berat atom unsur.
Jadual berkala unsur kimia ialah pengelasan unsur kimia berdasarkan ciri struktur tertentu atom unsur kimia. Ia disusun berdasarkan Undang-undang Berkala, yang ditemui pada tahun 1869 oleh D. I. Mendeleev. Pada masa itu, Jadual Berkala mengandungi 63 unsur kimia dan berbeza dari segi rupa daripada yang moden. Kini Jadual Berkala merangkumi kira-kira seratus dua puluh unsur kimia.
Jadual berkala disusun dalam bentuk jadual di mana unsur kimia disusun dalam susunan tertentu: apabila jisim atomnya meningkat. Kini terdapat banyak jenis imej Jadual Berkala. Yang paling biasa ialah imej dalam bentuk jadual dengan elemen yang disusun dari kiri ke kanan.
Semua unsur kimia dalam Jadual Berkala dikumpulkan ke dalam tempoh dan kumpulan. Jadual berkala merangkumi tujuh tempoh dan lapan kumpulan. Kala ialah siri mendatar unsur kimia di mana sifat unsur berubah daripada logam biasa kepada bukan logam. Lajur menegak unsur kimia yang mengandungi unsur dengan sifat kimia yang serupa membentuk kumpulan unsur kimia.
Tempoh pertama, kedua dan ketiga dipanggil kecil kerana ia mengandungi sebilangan kecil unsur (yang pertama - dua unsur, kedua dan ketiga - lapan unsur setiap satu). Unsur-unsur kala kedua dan ketiga dipanggil tipikal; sifatnya secara semula jadi berubah daripada logam biasa kepada gas lengai.
Semua tempoh lain dipanggil besar (yang keempat dan kelima mengandungi 18 unsur, yang keenam - 32 dan yang ketujuh - 24 unsur). Sifat yang hampir serupa ditunjukkan oleh unsur yang terletak dalam tempoh yang besar pada penghujung setiap baris genap. Ini adalah triad yang dipanggil: Ferum - Kobalt - Nicol, yang membentuk keluarga besi, dan dua yang lain: Ruthenium - Rhodium - Palladium dan Osmium - Iridium - Platinum, yang membentuk keluarga logam platinum (platinoids).
Di bahagian bawah jadual D.I. Mendeleev adalah unsur kimia yang membentuk keluarga lantanida dan keluarga aktinida. Semua unsur ini secara rasmi dimasukkan ke dalam kumpulan ketiga dan datang selepas unsur kimia lanthanum (nombor 57) dan aktinium (nombor 89).
Jadual berkala unsur mengandungi sepuluh baris. Noktah kecil (pertama, kedua dan ketiga) terdiri daripada satu baris, noktah besar (keempat, kelima dan keenam) mengandungi dua baris setiap satu. Terdapat satu baris dalam tempoh ketujuh.
Setiap tempoh utama terdiri daripada siri genap dan ganjil. Baris berpasangan mengandungi unsur logam; dalam baris ganjil, sifat unsur berubah seperti dalam unsur piawai, i.e. daripada logam kepada sebutan bukan logam.
Setiap kumpulan jadual D.I. Mendeleev terdiri daripada dua subkumpulan: utama dan menengah. Subkumpulan utama termasuk elemen kedua-dua tempoh kecil dan besar, iaitu subkumpulan utama bermula sama ada dengan tempoh pertama atau kedua. Subkumpulan sekunder termasuk unsur-unsur hanya tempoh yang panjang, i.e. subkumpulan sekunder bermula hanya dari tempoh keempat.
SISTEM BERKALA, set bahan kimia yang ditempah. unsur, sifat mereka. , yang merupakan ungkapan jadual. Prototaip berkala sistem kimia unsur adalah berdasarkan jadual "Pengalaman sistem unsur berdasarkan persamaan kimianya," yang disusun oleh D. I. Mendeleev pada 1 Mac 1869 (Rajah 1). akhir sekali Selama bertahun-tahun, saintis menambah baik jadual, membangunkan idea tentang tempoh dan kumpulan unsur dan tempat unsur dalam sistem. Pada tahun 1870, Mendeleev memanggil sistem semula jadi, dan pada tahun 1871 berkala. Akibatnya, sistem berkala dalam banyak aspek memperoleh bentuk modennya. garis besar struktur. Berdasarkan itu, Mendeleev meramalkan kewujudan orang kudus ca. 10 elemen yang tidak diketahui; ramalan ini kemudiannya disahkan.
nasi. 1 Jadual “Pengalaman sistem unsur berdasarkan persamaan kimianya” (D. I. Mendeleev. I myrtle 1869).
Walau bagaimanapun, dalam tempoh lebih daripada 40 tahun akan datang, jadual berkala bermakna. ijazah hanya empirikal. generalisasi fakta, kerana tidak ada fizikal penerangan sebab berkala. perubahan dalam elemen CB-B bergantung kepada peningkatannya. Penjelasan sedemikian adalah mustahil tanpa idea yang berasas tentang struktur (lihat). Oleh itu, pencapaian terpenting dalam pembangunan jadual berkala ialah model planet (nuklear) yang dicadangkan oleh E. Rutherford (1911). Pada tahun 1913, A. van den Broek membuat kesimpulan bahawa unsur dalam jadual berkala secara numerik sama dengan posi. cas (Z) nukleusnya. Kesimpulan ini telah disahkan secara eksperimen oleh G. Moseley (undang-undang Moseley, 1913-14). Akibatnya, berkala undang-undang menerima fizikal yang ketat perumusan, adalah mungkin untuk menentukan dengan jelas perkara berikut. sempadan jadual berkala (H sebagai unsur dengan minimum Z=1), anggarkan bilangan tepat unsur antara H dan U dan tentukan unsur yang belum ditemui (Z = 43, 61, 72, 75, 85 , 87). Teori jadual berkala telah dibangunkan pada awalnya. 1920-an (lihat di bawah).
Struktur jadual berkala. Sistem berkala moden merangkumi 109 unsur kimia (terdapat maklumat tentang sintesis pada tahun 1988 unsur dengan Z = 110). Daripada jumlah ini secara semula jadi objek ditemui 89; semua unsur yang mengikuti U, atau (Z = 93 109), serta Tc (Z = 43), Pm (Z = 61) dan At (Z = 85) telah disintesis secara buatan menggunakan decomp. . Elemen dengan Z = 106 109 belum menerima nama, jadi tiada simbol yang sepadan dalam jadual; untuk elemen dengan Z = 109 nilai maksimum masih tidak diketahui. panjang umur
Sepanjang sejarah jadual berkala, lebih daripada 500 versi berbeza imejnya telah diterbitkan. Ini disebabkan oleh percubaan untuk mencari penyelesaian rasional untuk masalah kontroversi tertentu struktur jadual berkala (peletakan H, lantanida, dll.). Naib. tersebar seperti berikut. bentuk jadual ungkapan sistem berkala: 1) yang pendek dicadangkan oleh Mendeleev (dalam bentuk semasa ia diletakkan pada permulaan volum pada flyleaf berwarna); 2) yang panjang dibangunkan oleh Mendeleev, diperbaiki pada tahun 1905 oleh A. Werner (Rajah 2); 3) tangga diterbitkan pada tahun 1921 H. (Rajah 3). Dalam dekad kebelakangan ini, bentuk pendek dan panjang telah digunakan secara meluas, kerana ia adalah visual dan boleh dikatakan mudah. Semua tersenarai. bentuk mempunyai kelebihan dan kekurangan tertentu. Walau bagaimanapun, sukar untuk menawarkan k.-l. universiti. varian daripada perwakilan jadual berkala, yang akan mencerminkan secukupnya semua kepelbagaian dunia kimia. unsur dan spesifik perubahan dalam kimianya. tingkah laku apabila Z meningkat.
Fundam. Prinsip membina jadual berkala adalah untuk membezakan tempoh (baris mendatar) dan kumpulan (lajur menegak) unsur di dalamnya. Sistem berkala moden terdiri daripada 7 tempoh (ketujuh, belum selesai, harus berakhir dengan unsur hipotesis dengan Z = 118) dan 8 kumpulan. Tempoh itu dipanggil. satu set elemen yang bermula (atau tempoh pertama) dan berakhir. Bilangan unsur dalam tempoh secara semula jadi meningkat dan, bermula dari yang kedua, ulang secara berpasangan: 8, 8, 18, 18, 32, 32, ... (kes khas ialah tempoh pertama, mengandungi hanya dua unsur). Kumpulan unsur tidak mempunyai definisi yang jelas; Secara rasmi, bilangannya sepadan dengan maks. maksud unsur konstituennya, tetapi syarat ini tidak dipenuhi dalam beberapa kes. Setiap kumpulan dibahagikan kepada subkumpulan utama (a) dan sekunder (b); setiap satunya mengandungi unsur yang serupa secara kimia. St anda, yang dicirikan oleh struktur luaran yang sama. cengkerang elektronik. Dalam kebanyakan kumpulan, unsur subkumpulan a dan b mempamerkan bahan kimia tertentu. persamaan, prem. dalam lebih tinggi.
Kumpulan VIII menduduki tempat yang istimewa dalam struktur jadual berkala. Untuk masa yang lama masa, hanya unsur "triad" yang dikaitkan dengannya: Fe-Co-Ni dan (Ru Rh Pd dan Os-Ir-Pt), dan semuanya diletakkan dalam kedudukan bebas. kumpulan sifar; oleh itu, jadual berkala mengandungi 9 kumpulan. Selepas pada tahun 60-an. telah diterima samb. Xe, Kr dan Rn mula diletakkan dalam subkumpulan VIIIa, dan kumpulan sifar telah dimansuhkan. Unsur-unsur triad membentuk subkumpulan VIII6. "reka bentuk struktur" kumpulan VIII ini kini muncul dalam hampir semua ungkapan yang diterbitkan dalam jadual berkala.
Akan membezakan. Ciri tempoh pertama ialah ia mengandungi hanya 2 unsur: H dan He. kerana suci - kesatuan. unsur yang tidak mempunyai tempat yang jelas dalam jadual berkala. Simbol H diletakkan sama ada dalam subkumpulan Ia, atau dalam subkumpulan VIIa, atau dalam kedua-duanya pada masa yang sama, melampirkan simbol dalam kurungan dalam salah satu subkumpulan, atau, akhirnya, menggambarkannya sebagai dipisahkan. fon. Cara penyusunan H ini adalah berdasarkan fakta bahawa ia mempunyai persamaan formal tertentu dengan kedua-duanya .

nasi. 2. Berkala bentuk panjang. sistem kimia elemen (versi moden). nasi. 3. Tangga bentuk berkala. sistem kimia unsur (H., 1921).
Tempoh kedua (Li-Ne), mengandungi 8 unsur, bermula dengan Li (perpaduan, + 1); diikuti dengan Be(+2). metalik aksara B (+3) dinyatakan dengan lemah, dan yang seterusnya, C, adalah tipikal (+4). Berikut ialah N, O, F dan Ne-bukan logam, dengan hanya N yang mempunyai + 5 tertinggi sepadan dengan nombor kumpulan; O dan F adalah antara yang paling aktif.
Tempoh ketiga (Na-Ar) juga merangkumi 8 unsur, sifat perubahan kimia. St di mana dalam banyak cara serupa dengan yang diperhatikan dalam tempoh kedua. Walau bagaimanapun, Mg dan Al adalah lebih "logam" daripada yang sepadan. Be dan B. Unsur yang tinggal ialah Si, P, S, Cl dan Ar bukan logam; mereka semua mempamerkan , sama dengan nombor kumpulan, kecuali Ar. T.arr., dalam tempoh kedua dan ketiga, apabila Z meningkat, kelemahan logam dan peningkatan bukan logam diperhatikan. sifat unsur.
Semua unsur tiga tempoh pertama tergolong dalam subkumpulan a. Mengikut moden terminologi, unsur kepunyaan subkumpulan Ia dan IIa dipanggil. I-elemen (dalam jadual warna simbol mereka diberikan dalam warna merah), kepada subkumpulan IIIa-VIIIa-p-elemen (simbol oren).
Periode keempat (K-Kr) mengandungi 18 unsur. Selepas K dan alkali-bumi. Ca (unsur-s) mengikuti satu siri 10 yang dipanggil. peralihan (Sc-Zn), atau unsur-d (simbol biru), yang termasuk dalam subkumpulan b. Majoriti (semuanya - ) mempamerkan lebih tinggi , sama dengan nombor kumpulan, tidak termasuk triad Fe-Co-Ni, di mana Fe dalam keadaan tertentu mempunyai +6, dan Co dan Ni adalah trivalen maksimum. Unsur dari Ga hingga Kr tergolong dalam subkumpulan a (elemen-p), dan sifat perubahan sifatnya dalam banyak cara serupa dengan perubahan sifat unsur periode kedua dan ketiga dalam selang nilai Z yang sepadan. Untuk Kr, beberapa telah diperolehi. sebatian yang agak stabil, terutamanya dengan F.

Tempoh kelima (Rb-Xe) dibina sama dengan tempoh keempat; ia juga mempunyai sisipan 10 peralihan, atau unsur-d (Y-Cd). Keanehan perubahan dalam kekuatan unsur dalam tempoh: 1) dalam triad Ru-Rh-Pd menunjukkan maksimum 4-8; 2) semua elemen subkumpulan a, termasuk Xe, mempamerkan nilai yang lebih tinggi bersamaan dengan nombor kumpulan; 3) Saya mempunyai sifat logam yang lemah. St. T. contoh, sifat unsur kala keempat dan kelima berubah dengan lebih kompleks apabila Z meningkat daripada sifat unsur dalam kala kedua dan ketiga, yang disebabkan terutamanya oleh kehadiran unsur-d peralihan.
Periode keenam (Cs-Rn) mengandungi 32 unsur. Sebagai tambahan kepada sepuluh unsur-d (La, Hf-Hg), ia termasuk keluarga 14 elemen-f (simbol hitam, dari Ce hingga Lu)-lantanida. Mereka sangat serupa dalam kimia. Suci kepada anda (sebaik-baiknya pada +3) dan oleh itu tidak boleh. diletakkan mengikut berbeza kumpulan sistem. Dalam bentuk pendek jadual berkala, semua lantanida termasuk dalam subkumpulan IIIa (La), dan keseluruhannya dihuraikan di bawah jadual. Teknik ini bukan tanpa kelemahannya, kerana 14 elemen kelihatan berada di luar sistem. Dalam bentuk panjang dan tangga sistem berkala, kekhususan dicerminkan dalam latar belakang umum strukturnya. Dr. ciri-ciri unsur zaman: 1) dalam triad Os Ir Pt, hanya Os mempamerkan maks. +8; 2) At mempunyai kesan logam yang lebih ketara berbanding dengan I. watak; 3) Rn maks. adalah reaktif, tetapi kimianya yang kuat menyukarkan untuk belajar. St.
Tempoh ketujuh, seperti yang keenam, harus mengandungi 32 elemen, tetapi belum selesai. Unsur Fr dan Ra masing-masing. subkumpulan Ia dan IIa, Ac ialah analog unsur subkumpulan III6. Menurut konsep aktinida G. Seaborg (1944), selepas Ac datang satu keluarga 14 unsur f (Z = 90 103). Dalam bentuk pendek jadual berkala, yang terakhir dimasukkan ke dalam Ac dan juga ditulis sebagai dept. garisan di bawah meja. Teknik ini mengandaikan kehadiran bahan kimia tertentu. persamaan antara elemen dua keluarga-f. Walau bagaimanapun, kajian terperinci menunjukkan bahawa ia mempamerkan julat yang lebih luas, termasuk seperti +7 (Np, Pu, Am). Di samping itu, yang berat dicirikan oleh penstabilan yang lebih rendah (+ 2 atau bahkan +1 untuk Md).
Penilaian kimia sifat Ku (Z = 104) dan Ns (Z = 105), yang disintesis dalam beberapa unsur tunggal yang berumur sangat singkat, membolehkan kami membuat kesimpulan bahawa unsur-unsur ini adalah analog masing-masing. Hf dan Ta, iaitu d-elemen, dan harus terletak dalam subkumpulan IV6 dan V6. Kimia. elemen dengan Z = 106 109 tidak dijalankan, tetapi boleh diandaikan bahawa ia tergolong dalam tempoh ketujuh. Pengiraan komputer menunjukkan bahawa unsur dengan Z = 113,118 tergolong dalam unsur p (subkumpulan IIIa VIIIa).
Teori jadual berkala adalah preem. dicipta oleh H. (1913 21) berdasarkan model kuantum yang dicadangkannya. Mengambil kira spesifik perubahan dalam sifat unsur dalam sistem berkala dan maklumat mengenainya, beliau membangunkan skema untuk membina konfigurasi elektronik apabila Z meningkat, menjadikannya asas untuk menerangkan fenomena berkala dan struktur sistem berkala . Skim ini adalah berdasarkan urutan tertentu bagi mengisi cangkerang (juga dipanggil lapisan, aras) dan subkulit (cengkerang, subperingkat) selaras dengan peningkatan dalam Z. Konfigurasi elektronik yang serupa samb. kulit elektron berulang secara berkala, yang menentukan keberkalaan. perubahan kimia unsur St. Inilah yang ch. menyebabkan fizikal sifat fenomena berkala. Cangkang elektronik, kecuali yang sepadan dengan nilai 1 dan 2 nombor kuantum utama l, tidak diisi secara berurutan dan monoton sehingga selesai sepenuhnya (nombor dalam cangkerang berjujukan ialah: 2, 8, 18, 32, 50,... ); pembinaannya secara berkala terganggu oleh kemunculan agregat (membentuk subkulit tertentu), yang sepadan dengan nilai besar n. Ini adalah intipati makhluk. keanehan tafsiran "elektronik" struktur jadual berkala.
Skim untuk pembentukan konfigurasi elektronik, yang mendasari teori sistem berkala, dengan itu mencerminkan urutan penampilan tertentu apabila Z tumbuh daripada agregat (subkulit), dicirikan oleh nilai tertentu bagi nombor kuantum utama dan orbital (l). . Skim ini biasanya ditulis dalam bentuk jadual. (lihat di bawah).
Garis menegak memisahkan subkulit, yang diisi ke dalam elemen yang membentuk jujukan. tempoh sistem berkala (nombor tempoh ditunjukkan oleh nombor di bahagian atas); Subkulit yang melengkapkan pembentukan cangkerang dengan item tertentu diserlahkan dalam huruf tebal.
Nombor dalam kulit dan subkulit ditakrifkan pada . Berhubung dengan , sebagai zarah dengan separuh integer, dia tidak membuat dalil bahawa sama sekali. dua dengan nilai yang sama bagi semua nombor kuantum. Kapasiti cengkerang dan subkulit adalah sama, masing-masing. 2n 2 dan 2(2l + 1). Prinsip ini tidak menentukan.
|
Tempoh |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
||
|
Konfigurasi elektronik |
1s |
2s 2р |
3s 3р |
4s 3d 4p |
5s 4d 5p |
6s 4f 5d 6p |
7s 5f 6d 7p |
||
|
n |
l |
22 |
33 |
434 |
545 |
6456 |
7567 |
||
|
l |
0 |
01 |
01 |
021 |
021 |
0321 |
0321 |
||
|
2 |
26 |
26 |
2106 |
2106 |
214106 |
214106 |
|||
|
Bilangan unsur dalam tempoh |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
||
walau bagaimanapun, turutan pembentukan konfigurasi elektronik apabila Z meningkat. Daripada rajah di atas, kapasitansi didapati secara bersiri. tempoh: 2, 8, 18, 32, 32, ....
Setiap noktah bermula dengan unsur di mana ia mula-mula muncul dengan nilai tertentu n pada l = 0 (ns 1 -elemen), dan berakhir dengan unsur di mana subkulit dengan n dan l = 1 yang sama diisi (np 6 -elemen Anda); pengecualian ialah tempoh pertama (elemen 1s sahaja). Semua elemen s dan p tergolong dalam subkumpulan a. Subkumpulan b termasuk elemen di mana cangkerang yang sebelum ini dibiarkan belum selesai dilengkapkan (nilai h kurang daripada nombor tempoh, l = 2 dan 3). Tiga tempoh pertama termasuk unsur subkumpulan a sahaja, iaitu s- dan p-elemen.
Skim sebenar untuk membina konfigurasi elektronik diterangkan oleh apa yang dipanggil. (n + l)-peraturan yang dirumuskan (1951) oleh V. M. Klechkovsky. Pembinaan konfigurasi elektronik berlaku mengikut peningkatan berturut-turut dalam jumlah (n + /). Selain itu, dalam setiap jumlah tersebut, subkulit dengan l yang lebih besar dan n yang lebih kecil terlebih dahulu diisi, kemudian dengan l yang lebih kecil dan n yang lebih besar.
Bermula dari tempoh keenam, pembinaan konfigurasi elektronik sebenarnya menjadi lebih kompleks, yang dinyatakan dalam pelanggaran sempadan yang jelas antara subkulit yang diisi berturut-turut. Sebagai contoh, elektron 4f tidak muncul dalam La dengan Z = 57, tetapi dalam satu Ce berikutnya (Z = 58); berurutan pembinaan subkulit 4f terganggu dalam Gd (Z = 64, kehadiran elektron 5d). "Kekaburan periodicity" sedemikian jelas mempengaruhi tempoh ketujuh untuk Z > 89, yang ditunjukkan dalam sifat unsur-unsur.
Skim sebenar tidak asalnya berasal daripada k.-l. teori yang ketat perwakilan. Ia berdasarkan kimia terkenal. unsur suci dan maklumat tentang spektrumnya. sah fizikal skim sebenar menerima justifikasinya melalui penggunaan kaedah untuk penerangan struktur. Dalam mekanik kuantum. tafsiran teori struktur, konsep cengkerang elektronik dan subkulit dengan pendekatan yang ketat telah kehilangan makna asalnya; konsep atom kini digunakan secara meluas. Namun begitu, prinsip fizikal yang dibangunkan tafsiran fenomena berkala tidak kehilangan kepentingannya dan, kepada anggaran pertama, menerangkan teori teori dengan agak komprehensif. asas jadual berkala. Walau apa pun, bentuk jadual berkala yang diterbitkan mencerminkan idea tentang sifat pengedaran antara kulit dan subkulit.
Struktur dan sifat kimia unsur. Ciri-ciri utama kimia. kelakuan unsur ditentukan oleh sifat konfigurasi kulit elektron luar (satu atau dua). Ciri ini berbeza untuk unsur subkumpulan a (elemen s dan p), subkumpulan b (elemen d), keluarga f ( dan ).
Tempat istimewa diduduki oleh unsur 1s tempoh pertama (H dan He). disebabkan kehadiran dalam satu sahaja terdapat perbezaan yang besarSt. Konfigurasi He (1s 2) adalah luar biasa, yang menentukan kimianya inersia. Oleh kerana unsur-unsur subkumpulan a diisi dengan samb. kulit elektron (dengan n sama dengan nombor tempoh), sifat unsur berubah dengan ketara apabila Z meningkat dalam tempoh yang sepadan, yang dinyatakan dalam kelemahan logam dan pengukuhan bukan logam. St. Semua kecuali H dan Dia adalah unsur-p. Pada masa yang sama, dalam setiap subkumpulan a, apabila Z meningkat, peningkatan dalam metalliciti diperhatikan. St. Corak ini dijelaskan oleh kelemahan tenaga pengikat luaran. dengan teras semasa peralihan dari tempoh ke tempoh.
Maksud jadual berkala. Sistem ini telah memainkan dan terus memainkan peranan yang besar dalam pembangunan pluralisme. sains semula jadi disiplin. Dia menjadi penghubung penting dalam dermaga atom. ajaran, menyumbang kepada perumusan moden. konsep "unsur kimia" dan penjelasan idea tentang bahan dan sebatian ringkas. pengaruh terhadap perkembangan teori struktur dan kemunculan konsep isotopi. Tegas saintifik berkaitan dengan sistem berkala. perumusan masalah ramalan dalam itumemanifestasikan dirinya dalam ramalan kewujudan unsur yang tidak diketahui dan sifatnya, serta ciri kimia baru. tingkah laku elemen yang telah dibuka. Jadual berkala adalah asas terpenting bagi inorg. ; ia berfungsi, sebagai contoh, tugas mensintesis bahan dengan sifat yang telah ditetapkan, mencipta bahan baharu, khususnya bahan semikonduktor, dan memilih bahan tertentu. untuk diff. kimia. proses. Sistem berkala - saintifik. asas pengajaran am dan bukan organisasi , serta cabang fizik atom tertentu.
Lit.: Mendeleev D.I., Undang-undang berkala. Artikel asas, M., 1958; Kedrov B. M.. Tiga aspek atomisme, bahagian 3. Undang-undang Mendeleev, M., 1969; Trifonov D N., Mengenai tafsiran kuantitatif periodicity, M., 1971; Trifonov D. N., Krivomazov A. N., Lisnevsky Yu. I., Doktrin berkala dan doktrin. Gabungan kronologi peristiwa yang paling penting. M., 1974; Karapetyami MX. Drakii S.I., Stroenie, M., 1978; Doktrin berkala. Sejarah dan kemodenan. Sab. artikel. M.. 1981. Korolkov D.V., Asas, M., 1982; Melnikov V.P., Dmitriev I.S. Jenis tambahan berkala dalam sistem berkala D.I. Mendeleev, M. 1988. D.N Trifonov.
Jadual berkala unsur kimia (jadual berkala)- pengelasan unsur kimia, mewujudkan pergantungan pelbagai sifat unsur pada cas nukleus atom. Sistem ini adalah ungkapan grafik undang-undang berkala yang ditubuhkan oleh ahli kimia Rusia D. I. Mendeleev pada tahun 1869. Versi asalnya telah dibangunkan oleh D.I. Mendeleev pada 1869-1871 dan menetapkan pergantungan sifat unsur pada berat atomnya (dalam istilah moden, pada jisim atom). Secara keseluruhan, beberapa ratus pilihan untuk menggambarkan sistem berkala (lengkung analitik, jadual, angka geometri, dll.) telah dicadangkan. Dalam versi moden sistem, diandaikan bahawa unsur-unsur diringkaskan dalam jadual dua dimensi, di mana setiap lajur (kumpulan) mentakrifkan sifat fizikal dan kimia utama, dan baris mewakili tempoh yang pada tahap tertentu serupa. untuk setiap seorang.
Jadual berkala unsur kimia oleh D.I. Mendeleev
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Penemuan yang dibuat oleh ahli kimia Rusia Mendeleev memainkan (setakat ini) peranan yang paling penting dalam perkembangan sains, iaitu dalam pembangunan sains atom-molekul. Penemuan ini memungkinkan untuk mendapatkan idea yang paling mudah difahami dan mudah dipelajari tentang sebatian kimia yang ringkas dan kompleks. Hanya terima kasih kepada jadual bahawa kita mempunyai konsep tentang unsur-unsur yang kita gunakan dalam dunia moden. Pada abad kedua puluh, peranan ramalan sistem berkala dalam menilai sifat kimia unsur transuranium, yang ditunjukkan oleh pencipta jadual, muncul.
Dibangunkan pada abad ke-19, jadual berkala Mendeleev untuk kepentingan sains kimia menyediakan sistematisasi siap sedia jenis-jenis atom untuk pembangunan FIZIK pada abad ke-20 (fizik atom dan nukleus atom). Pada awal abad kedua puluh, ahli fizik, melalui penyelidikan, menetapkan bahawa nombor atom (juga dikenali sebagai nombor atom) juga merupakan ukuran cas elektrik nukleus atom unsur ini. Dan bilangan tempoh (iaitu, siri mendatar) menentukan bilangan kulit elektron atom. Ia juga ternyata bahawa bilangan baris menegak jadual menentukan struktur kuantum kulit luar unsur (oleh itu, unsur-unsur baris yang sama wajib mempunyai sifat kimia yang serupa).
Penemuan saintis Rusia menandakan era baru dalam sejarah sains dunia; penemuan ini membolehkan bukan sahaja membuat lompatan besar dalam kimia, tetapi juga tidak ternilai untuk beberapa bidang sains lain. Jadual berkala menyediakan sistem maklumat yang koheren tentang unsur-unsur, berdasarkannya, ia menjadi mungkin untuk membuat kesimpulan saintifik, dan juga menjangkakan beberapa penemuan.
Jadual Berkala Salah satu ciri jadual berkala ialah kumpulan (lajur dalam jadual) mempunyai ungkapan yang lebih ketara bagi arah aliran berkala berbanding untuk tempoh atau blok. Pada masa kini, teori mekanik kuantum dan struktur atom menerangkan intipati kumpulan unsur-unsur dengan fakta bahawa mereka mempunyai konfigurasi elektronik yang sama bagi cengkerang valensi, dan sebagai hasilnya, unsur-unsur yang terletak dalam lajur yang sama mempunyai ciri yang hampir sama (sama). konfigurasi elektronik, dengan sifat kimia yang serupa. Terdapat juga kecenderungan yang jelas untuk perubahan sifat yang stabil apabila jisim atom bertambah. Perlu diingatkan bahawa dalam beberapa kawasan jadual berkala (contohnya, dalam blok D dan F), persamaan mendatar lebih ketara daripada yang menegak.
Jadual berkala mengandungi kumpulan yang diberi nombor siri dari 1 hingga 18 (dari kiri ke kanan), mengikut sistem penamaan kumpulan antarabangsa. Pada masa lalu, angka Rom digunakan untuk mengenal pasti kumpulan. Di Amerika, terdapat amalan meletakkan selepas angka Rom, huruf "A" apabila kumpulan itu terletak di blok S dan P, atau huruf "B" untuk kumpulan yang terletak di blok D. Pengecam yang digunakan pada masa itu ialah sama seperti yang terakhir bilangan indeks moden pada zaman kita (contohnya, nama IVB sepadan dengan unsur kumpulan 4 pada zaman kita, dan IVA ialah kumpulan unsur ke-14). Di negara-negara Eropah pada masa itu, sistem serupa digunakan, tetapi di sini, huruf "A" merujuk kepada kumpulan hingga 10, dan huruf "B" - selepas 10 termasuk. Tetapi kumpulan 8,9,10 mempunyai ID VIII, sebagai satu kumpulan tiga kali ganda. Nama kumpulan ini tidak lagi wujud selepas sistem tatatanda IUPAC yang baharu, yang masih digunakan hari ini, berkuat kuasa pada tahun 1988.
Banyak kumpulan menerima nama tidak sistematik yang bersifat herba (contohnya, "logam tanah beralkali", atau "halogen", dan nama lain yang serupa). Kumpulan 3 hingga 14 tidak menerima nama sedemikian, kerana fakta bahawa mereka kurang serupa antara satu sama lain dan kurang mematuhi corak menegak; mereka biasanya dipanggil sama ada dengan nombor atau dengan nama unsur pertama kumpulan (titanium , kobalt, dsb.).
Unsur kimia yang tergolong dalam kumpulan jadual berkala yang sama menunjukkan arah aliran tertentu dalam keelektronegatifan, jejari atom dan tenaga pengionan. Dalam satu kumpulan, dari atas ke bawah, jejari atom meningkat apabila tahap tenaga diisi, elektron valens unsur bergerak menjauhi nukleus, manakala tenaga pengionan berkurangan dan ikatan dalam atom menjadi lemah, yang memudahkan penyingkiran elektron. Keelektronegatifan juga berkurangan, ini adalah akibat dari fakta bahawa jarak antara nukleus dan elektron valens meningkat. Tetapi terdapat juga pengecualian untuk corak ini, sebagai contoh, keelektronegatifan meningkat, bukannya menurun, dalam kumpulan 11, dalam arah dari atas ke bawah. Terdapat garis dalam jadual berkala yang dipanggil "Tempoh".
Di antara kumpulan, terdapat kumpulan yang arah mendatarnya lebih ketara (tidak seperti yang lain di mana arah menegak lebih penting), kumpulan tersebut termasuk blok F, di mana lantanida dan aktinida membentuk dua jujukan mendatar yang penting.
Unsur menunjukkan corak tertentu dalam jejari atom, keelektronegatifan, tenaga pengionan dan tenaga pertalian elektron. Disebabkan fakta bahawa untuk setiap unsur berikutnya bilangan zarah bercas bertambah, dan elektron tertarik kepada nukleus, jejari atom berkurangan dari kiri ke kanan, bersama-sama dengan ini tenaga pengionan meningkat, dan apabila ikatan dalam atom meningkat, kesukaran untuk mengeluarkan elektron meningkat. Logam yang terletak di sebelah kiri jadual dicirikan oleh penunjuk tenaga pertalian elektron yang lebih rendah, dan oleh itu, di sebelah kanan penunjuk tenaga pertalian elektron lebih tinggi untuk bukan logam (tidak mengira gas mulia).
Kawasan yang berbeza dalam jadual berkala, bergantung pada petala atom yang mana elektron terakhir terletak, dan memandangkan kepentingan petala elektron, biasanya digambarkan sebagai blok.
Blok S termasuk dua kumpulan pertama unsur (logam alkali dan alkali tanah, hidrogen dan helium).
Blok P termasuk enam kumpulan terakhir, dari 13 hingga 18 (mengikut IUPAC, atau mengikut sistem yang diterima pakai di Amerika - dari IIIA hingga VIIIA), blok ini juga termasuk semua metaloid.
Blok - D, kumpulan 3 hingga 12 (IUPAC, atau IIIB hingga IIB dalam bahasa Amerika), blok ini termasuk semua logam peralihan.
Blok - F, biasanya diletakkan di luar jadual berkala, dan termasuk lantanida dan aktinida.
Jadual berkala unsur D.I. Mendeleev, semula jadi, yang merupakan ungkapan jadual (atau grafik lain). Jadual berkala unsur telah dibangunkan oleh D.I. Mendeleev pada tahun 1869-1871.
Sejarah jadual berkala unsur. Percubaan untuk sistematisasi telah dibuat oleh pelbagai saintis di England dan Amerika Syarikat sejak 30-an abad ke-19. Mendeleev - I. Döbereiner, J. Dumas, ahli kimia Perancis A. Chancourtois, Inggeris. ahli kimia W. Odling, J. Newlands dan lain-lain menubuhkan kewujudan kumpulan unsur dengan sifat kimia yang serupa, yang dipanggil "kumpulan semula jadi" (contohnya, "triad" Döbereiner). Walau bagaimanapun, saintis ini tidak pergi lebih jauh daripada mewujudkan corak tertentu dalam kumpulan. Pada tahun 1864, L. Meyer, berdasarkan data, mencadangkan jadual yang menunjukkan nisbah untuk beberapa kumpulan ciri unsur. Meyer tidak membuat mesej teori dari mejanya.
Prototaip sistem berkala saintifik unsur ialah jadual "Pengalaman sistem unsur berdasarkan persamaan kimianya," yang disusun oleh Mendeleev pada 1 Mac 1869 ( nasi. 1). Dalam tempoh dua tahun akan datang, penulis menambah baik jadual ini, memperkenalkan idea tentang kumpulan, siri dan tempoh unsur; membuat percubaan untuk menganggarkan kapasiti tempoh kecil dan besar, yang mengandungi, pada pendapatnya, masing-masing 7 dan 17 elemen. Pada tahun 1870 dia memanggil sistemnya semula jadi, dan pada tahun 1871 - berkala. Walaupun begitu, struktur jadual berkala unsur memperoleh sebahagian besar garis besar moden ( nasi. 2).
Jadual unsur berkala tidak segera mendapat pengiktirafan sebagai generalisasi saintifik asas; keadaan berubah dengan ketara hanya selepas penemuan Ga, Sc, Ge dan penubuhan divalens Be (ia dianggap trivalen untuk masa yang lama). Namun begitu, sistem unsur berkala sebahagian besarnya mewakili generalisasi fakta empirikal, kerana makna fizikal undang-undang berkala itu tidak jelas dan tiada penjelasan untuk sebab-sebab perubahan berkala dalam sifat unsur bergantung kepada peningkatan. Oleh itu, sehingga pengesahan fizikal undang-undang berkala dan perkembangan teori sistem unsur berkala, banyak fakta tidak dapat dijelaskan. Oleh itu, penemuan pada akhir abad ke-19 adalah di luar jangkaan. , yang nampaknya tidak mempunyai tempat dalam jadual unsur berkala; kesukaran ini telah dihapuskan kerana kemasukan unsur kumpulan sifar bebas (kemudian subkumpulan VIIIa) ke dalam jadual berkala. Penemuan banyak "elemen radio" pada awal abad ke-20. membawa kepada percanggahan antara keperluan untuk penempatan mereka dalam jadual berkala unsur dan strukturnya (untuk lebih daripada 30 elemen sedemikian terdapat 7 tempat "kosong" dalam tempoh keenam dan ketujuh). Percanggahan ini dapat diatasi hasil daripada penemuan itu. Akhirnya, nilai () sebagai parameter yang menentukan sifat unsur secara beransur-ansur kehilangan maknanya.
Salah satu sebab utama ketidakmungkinan menjelaskan makna fizikal undang-undang berkala dan sistem unsur berkala ialah kekurangan teori struktur (lihat, Fizik atom). Oleh itu, peristiwa penting yang paling penting dalam pembangunan sistem berkala unsur ialah model planet yang dicadangkan oleh E. Rutherford (1911). Berdasarkan asasnya, saintis Belanda A. van den Broek mencadangkan (1913) bahawa unsur dalam jadual berkala unsur (Z) secara numerik sama dengan cas nukleus (dalam unit cas asas). Ini telah disahkan secara eksperimen oleh G. Moseley (1913-14, lihat undang-undang Moseley). Oleh itu, adalah mungkin untuk menentukan bahawa kekerapan perubahan dalam sifat unsur bergantung pada , dan bukan pada . Akibatnya, had bawah sistem berkala unsur ditentukan secara saintifik (sebagai unsur dengan minimum Z = 1); bilangan elemen antara dan dianggarkan dengan tepat; Telah ditetapkan bahawa "jurang" dalam jadual berkala unsur sepadan dengan unsur yang tidak diketahui dengan Z = 43, 61, 72, 75, 85, 87.
Walau bagaimanapun, persoalan bilangan yang tepat masih tidak jelas, dan (apa yang paling penting) sebab-sebab perubahan berkala dalam sifat unsur-unsur bergantung kepada Z tidak didedahkan. Sebab-sebab ini ditemui semasa perkembangan lanjut teori berkala sistem unsur berdasarkan konsep kuantum struktur (lihat. Selanjutnya). Pembuktian fizikal undang-undang berkala dan penemuan fenomena isotonia memungkinkan untuk mentakrifkan secara saintifik konsep "" (“"). Jadual berkala yang dilampirkan (lihat sakit.) mengandungi nilai moden unsur pada skala karbon selaras dengan Jadual Antarabangsa 1973. Yang paling lama hidup diberikan dalam kurungan persegi. Daripada 99 Tc, 226 Ra, 231 Pa dan 237 Np yang paling stabil, ini diterima pakai (1969) oleh Suruhanjaya Antarabangsa pada.
Struktur jadual berkala unsur. Jadual unsur berkala moden (1975) meliputi 106; daripada ini, semua transuranium (Z = 93-106), serta unsur dengan Z = 43 (Tc), 61 (Pm), 85 (At) dan 87 (Fr) diperoleh secara buatan. Sepanjang sejarah sistem berkala unsur, sejumlah besar (beberapa ratus) varian perwakilan grafiknya telah dicadangkan, terutamanya dalam bentuk jadual; Imej juga dikenali dalam bentuk pelbagai angka geometri (spatial dan planar), lengkung analitikal (contohnya,), dsb. Yang paling meluas ialah tiga bentuk jadual unsur berkala: pendek, dicadangkan oleh Mendeleev ( nasi. 2) dan menerima pengiktirafan sejagat (dalam bentuk moden ia diberikan pada sakit.); panjang ( nasi. 3); tangga ( nasi. 4). Bentuk panjang juga dibangunkan oleh Mendeleev, dan dalam bentuk yang lebih baik ia dicadangkan pada tahun 1905 oleh A. Werner. Bentuk tangga telah dicadangkan oleh saintis Inggeris T. Bailey (1882), saintis Denmark J. Thomsen (1895) dan diperbaiki oleh N. (1921). Setiap tiga bentuk mempunyai kelebihan dan kekurangan. Prinsip asas membina jadual berkala unsur ialah pembahagian semua kepada kumpulan dan tempoh. Setiap kumpulan dibahagikan kepada subkumpulan utama (a) dan sekunder (b). Setiap subkumpulan mengandungi unsur-unsur yang mempunyai sifat kimia yang serupa. Unsur-unsur subkumpulan a- dan b dalam setiap kumpulan, sebagai peraturan, menunjukkan persamaan kimia tertentu antara satu sama lain, terutamanya dalam kumpulan yang lebih tinggi, yang, sebagai peraturan, sepadan dengan nombor kumpulan. Tempoh ialah satu set elemen yang bermula dan berakhir (kes khas ialah tempoh pertama); Setiap tempoh mengandungi bilangan elemen yang ditetapkan dengan ketat. Jadual berkala unsur terdiri daripada 8 kumpulan dan 7 tempoh (yang ketujuh belum selesai).
Kekhususan tempoh pertama ialah ia mengandungi hanya 2 unsur: H dan He. Tempat H dalam sistem adalah samar-samar: kerana ia mempamerkan sifat yang sama dengan dan dengannya, ia diletakkan sama ada dalam Ia-atau (sebaik-baiknya) dalam subkumpulan VIIa. - wakil pertama subkumpulan VIIa (namun, untuk masa yang lama, Ne dan semua orang digabungkan menjadi kumpulan sifar bebas).
Kala kedua (Li - Ne) mengandungi 8 unsur. Ia bermula dengan Li, satu-satunya yang sama dengan I. Kemudian datang Be - , II. Sifat logam unsur B seterusnya dinyatakan dengan lemah (III). C yang mengikutinya adalah tipikal dan boleh sama ada secara positif atau negatif tetravalen. N, O, F dan Ne - berikut, dan hanya untuk N V tertinggi sepadan dengan nombor kumpulan; hanya dalam kes yang jarang berlaku, ia menunjukkan positif, dan untuk F VI diketahui. Tempoh berakhir dengan Ne.
Tempoh ketiga (Na - Ar) juga mengandungi 8 unsur, sifat perubahan sifat yang sebahagian besarnya serupa dengan yang diperhatikan dalam tempoh kedua. Walau bagaimanapun, Mg, tidak seperti Be, adalah lebih logam, seperti Al berbanding B, walaupun Al adalah wujud. Si, P, S, Cl, Ar adalah tipikal, tetapi kesemuanya (kecuali Ar) mempamerkan nilai yang lebih tinggi sama dengan nombor kumpulan. Oleh itu, dalam kedua-dua tempoh, apabila Z meningkat, kelemahan logam dan pengukuhan sifat bukan logam unsur diperhatikan. Mendeleev memanggil unsur-unsur tempoh kedua dan ketiga (kecil, dalam istilahnya) tipikal. Adalah penting bahawa ia adalah antara yang paling biasa dalam alam semula jadi, dan C, N dan O adalah, bersama-sama dengan H, unsur utama bahan organik (organogen). Semua elemen tiga tempoh pertama termasuk dalam subkumpulan a.
Menurut terminologi moden (lihat di bawah), unsur-unsur zaman ini merujuk kepada unsur-s (alkali dan alkali tanah), komponen subkumpulan Ia- dan IIa (diserlahkan dalam warna merah pada jadual warna), dan unsur-p ( B - Ne, At - Ar), termasuk dalam subkumpulan IIIa - VIIIa (simbol mereka diserlahkan dalam oren). Untuk unsur-unsur tempoh kecil, dengan peningkatan, penurunan pertama diperhatikan, dan kemudian, apabila nombor dalam kulit luar sudah meningkat dengan ketara, tolakan bersama mereka membawa kepada peningkatan. Maksimum seterusnya dicapai pada permulaan tempoh seterusnya pada unsur alkali. Kira-kira corak yang sama adalah tipikal untuk.
Tempoh keempat (K - Kr) mengandungi 18 elemen (tempoh utama pertama, menurut Mendeleev). Selepas K dan alkali tanah Ca (s-elemen) datang satu siri sepuluh yang dipanggil (Sc - Zn), atau d-elemen (simbol diberikan dalam warna biru), yang termasuk dalam subkumpulan 6 kumpulan yang sepadan bagi jadual unsur berkala. Majoriti (semuanya) mempamerkan tahap yang lebih tinggi bersamaan dengan nombor kumpulan. Pengecualian ialah triad Fe - Co - Ni, di mana dua elemen terakhir adalah trivalen positif secara maksimum, dan dalam keadaan tertentu diketahui dalam VI. Unsur-unsur, bermula dengan Ga dan berakhir dengan Kr (elemen-p), tergolong dalam subkumpulan a, dan sifat perubahan sifatnya adalah sama seperti dalam selang Z yang sepadan untuk unsur-unsur kala kedua dan ketiga. Telah ditetapkan bahawa Kr mampu membentuk (terutama dengan F), tetapi VIII tidak diketahui untuknya.
Tempoh kelima (Rb - Xe) dibina sama dengan tempoh keempat; ia juga mempunyai sisipan 10 (Y - Cd), d-elemen. Ciri khusus tempoh: 1) dalam triad Ru - Rh - Pd hanya menunjukkan VIII; 2) semua elemen subkumpulan mempamerkan nilai yang lebih tinggi sama dengan nombor kumpulan, termasuk Xe; 3) Saya mempunyai sifat logam yang lemah. Oleh itu, sifat perubahan sifat apabila Z meningkat untuk unsur-unsur tempoh keempat dan kelima adalah lebih kompleks, kerana sifat logam dikekalkan dalam julat yang besar.
Tempoh keenam (Cs - Rn) merangkumi 32 elemen. Selain 10 d-elemen (La, Hf - Hg), ia mengandungi set 14 f-elemen, dari Ce ke Lu (simbol hitam). Unsur La melalui Lu secara kimia agak serupa. Dalam bentuk pendek jadual berkala, unsur-unsur dimasukkan dalam La (kerana ia adalah dominan III) dan ditulis sebagai garis berasingan di bahagian bawah jadual. Teknik ini agak menyusahkan, kerana 14 elemen kelihatan berada di luar jadual. Bentuk panjang dan tangga bagi sistem unsur berkala tidak mempunyai kelemahan sedemikian, yang mencerminkan kekhususan terhadap latar belakang struktur holistik sistem unsur berkala. Ciri-ciri tempoh: 1) dalam triad Os - Ir - Pt hanya menunjukkan VIII; 2) At mempunyai ciri logam yang lebih ketara (berbanding 1); 3) Rn, nampaknya (ia telah dikaji sedikit), sepatutnya menjadi yang paling reaktif daripada .
Tempoh ketujuh, bermula dengan Fr (Z = 87), juga harus mengandungi 32 elemen, yang mana 20 diketahui setakat ini (sehingga elemen dengan Z = 106). Fr dan Ra ialah unsur-unsur subkumpulan Ia- dan IIa, masing-masing (elemen-s), Ac ialah analog unsur-unsur subkumpulan IIIb (elemen-d). 14 elemen seterusnya, elemen-f (dengan Z dari 90 hingga 103), membentuk keluarga. Dalam bentuk pendek jadual berkala unsur, mereka menduduki Ac dan ditulis sebagai garis berasingan di bahagian bawah jadual, serupa dengan, berbeza dengan yang mereka dicirikan oleh kepelbagaian yang ketara. Sehubungan dengan ini, secara kimia siri ini menunjukkan perbezaan yang ketara. Kajian sifat kimia unsur dengan Z = 104 dan Z = 105 menunjukkan bahawa unsur-unsur ini adalah analog dan, masing-masing, iaitu unsur-d, dan harus diletakkan dalam subkumpulan IVb dan Vb. Elemen seterusnya sehingga Z = 112 juga mestilah ahli subkumpulan b, dan kemudian (Z = 113-118) elemen p (IIIa - subkumpulan VIlla) akan muncul.
Teori jadual berkala unsur. Teori sistem berkala unsur adalah berdasarkan idea corak khusus pembinaan cengkerang elektronik (lapisan, tahap) dan subkulit (cangkang, subperingkat) apabila Z meningkat (lihat, fizik Atom). Idea ini telah dibangunkan pada tahun 1913-21, dengan mengambil kira sifat perubahan sifat dalam jadual berkala unsur dan hasil kajian mereka. mendedahkan tiga ciri penting pembentukan konfigurasi elektronik: 1) pengisian cangkerang elektronik (kecuali cangkerang yang sepadan dengan nilai nombor kuantum utama n = 1 dan 2) tidak berlaku secara monoton sehingga kapasiti penuhnya, tetapi terganggu. dengan kemunculan agregat yang berkaitan dengan cengkerang dengan nilai n yang besar; 2) jenis konfigurasi elektronik yang serupa diulang secara berkala; 3) sempadan tempoh sistem unsur berkala (dengan pengecualian yang pertama dan kedua) tidak bertepatan dengan sempadan kulit elektron berturut-turut.
Dalam notasi yang diterima pakai dalam fizik atom, skema sebenar untuk pembentukan konfigurasi elektronik apabila Z meningkat secara amnya boleh ditulis seperti berikut:

Garis menegak memisahkan tempoh jadual berkala unsur (nombornya ditunjukkan dengan nombor di bahagian atas); Subkulit yang melengkapkan pembinaan cangkerang dengan n yang diberikan diserlahkan dalam huruf tebal. Di bawah sebutan subkulit ialah nilai nombor kuantum utama (n) dan orbital (l), yang mencirikan subkulit yang diisi berturut-turut. Selaras dengan, kapasiti setiap kulit elektron ialah 2n 2, dan kapasiti setiap subkulit ialah 2(2l + 1). Daripada rajah di atas, kapasiti tempoh berturut-turut mudah ditentukan: 2, 8, 8, 18, 18, 32, 32... Setiap tempoh bermula dengan unsur di mana ia muncul dengan nilai baru n. Oleh itu, tempoh boleh dicirikan sebagai koleksi unsur, bermula dengan unsur dengan nilai n sama dengan nombor kala, dan l = 0 (ns 1 -elemen), dan berakhir dengan unsur dengan n dan l = 1 yang sama ( np 6 -elemen); pengecualian ialah tempoh pertama, yang mengandungi hanya unsur ls. Dalam kes ini, subkumpulan-a termasuk unsur-unsur yang n adalah sama dengan nombor tempoh, dan l = 0 atau 1, iaitu, pembinaan kulit elektron dengan n tertentu berlaku. Subkumpulan b termasuk elemen di mana penyiapan cengkerang yang masih belum selesai berlaku (dalam kes ini, n adalah kurang daripada nombor tempoh, dan l = 2 atau 3). Periode pertama - ketiga jadual berkala unsur mengandungi hanya unsur subkumpulan a.
Skim sebenar yang diberikan untuk pembentukan konfigurasi elektronik tidak sempurna, kerana dalam beberapa kes, sempadan yang jelas antara subkulit yang diisi berturut-turut dilanggar (contohnya, selepas mengisi subkulit 6s dalam Cs dan Ba, bukan 4f, tetapi 5d. elektron muncul; terdapat elektron 5d dalam Gd dll.). Selain itu, litar sebenar asal tidak boleh diperoleh daripada sebarang konsep fizikal asas; kesimpulan sedemikian menjadi mungkin terima kasih kepada aplikasi kepada masalah struktur.
Jenis konfigurasi cengkerang elektronik luaran (pada sakit. konfigurasi ditunjukkan) menentukan ciri utama kelakuan kimia unsur. Ciri-ciri ini khusus untuk unsur-unsur subkumpulan a (elemen s dan p), subkumpulan b (elemen d) dan keluarga f ( dan ). Kes khas diwakili oleh unsur-unsur tempoh pertama (H dan He). Keatoman kimia yang tinggi dijelaskan oleh kemudahan detasmen bagi satu elektron ls, manakala konfigurasi (1s 2) adalah sangat kuat, yang menentukan lengai kimianya.
Oleh kerana kulit elektron terluar unsur subkumpulan a diisi (dengan n sama dengan nombor kala), sifat unsur berubah dengan ketara apabila Z meningkat. Oleh itu, dalam tempoh kedua Li (konfigurasi 2s 1) aktif secara kimia. , mudah kehilangan valens, a Be (2s 2) - juga, tetapi kurang aktif. Watak logam bagi unsur B seterusnya (2s 2 p) dinyatakan dengan lemah, dan semua unsur seterusnya bagi tempoh kedua, di mana subkulit 2p dibina, adalah lebih sempit. Konfigurasi lapan elektron bagi kulit elektron luar Ne (2s 2 p 6) adalah sangat kuat, oleh itu - . Corak perubahan sifat yang serupa diperhatikan dalam unsur-unsur tempoh ketiga dan dalam s- dan p-elemen semua tempoh berikutnya, bagaimanapun, kelemahan hubungan antara luaran dan teras dalam subkumpulan a apabila Z meningkat dengan cara tertentu. mempengaruhi sifat mereka. Oleh itu, bagi unsur-s terdapat peningkatan yang ketara dalam sifat kimia, dan bagi unsur-p terdapat peningkatan dalam sifat logam. Dalam subkumpulan VIIIa, kestabilan konfigurasi ns 2 np 6 menjadi lemah, akibatnya sudah Kr (tempoh keempat) memperoleh keupayaan untuk masuk. Kekhususan unsur-p tempoh ke-4-6 juga disebabkan oleh fakta bahawa ia dipisahkan daripada unsur-s oleh set unsur di mana pembinaan kulit elektron sebelumnya berlaku.
Untuk unsur-d peralihan b-subkumpulan, cangkerang yang tidak lengkap dengan n dilengkapkan dengan kurang satu daripada nombor tempoh. Konfigurasi cangkerang luar mereka, sebagai peraturan, ialah ns 2. Oleh itu semua elemen-d ialah . Struktur yang serupa bagi kulit luar unsur-d dalam setiap tempoh membawa kepada fakta bahawa perubahan dalam sifat-sifat unsur-d apabila Z meningkat adalah tidak ketara dan perbezaan yang jelas hanya terdapat pada yang lebih tinggi, di mana d -elemen menunjukkan persamaan tertentu dengan unsur p bagi kumpulan yang sepadan bagi tempoh berkala.sistem unsur. Kekhususan unsur subkumpulan VIIIb dijelaskan oleh fakta bahawa subkulit d mereka hampir siap, dan oleh itu unsur-unsur ini tidak cenderung (dengan pengecualian Ru dan Os) untuk mempamerkan lebih tinggi . Untuk unsur subkumpulan Ib (Cu, Ag, Au), subkulit d sebenarnya lengkap, tetapi belum cukup stabil; unsur ini juga mempamerkan unsur yang lebih tinggi (sehingga III dalam kes Au).
Maksud Jadual Berkala Unsur. Jadual berkala unsur telah memainkan dan terus memainkan peranan yang besar dalam pembangunan sains semula jadi. Ia merupakan pencapaian paling penting dalam sains molekul-atom, yang memungkinkan untuk memberikan definisi moden tentang konsep "" dan menjelaskan konsep sebatian. Corak yang didedahkan oleh sistem berkala unsur mempunyai kesan yang signifikan terhadap perkembangan teori struktur dan menyumbang kepada penjelasan fenomena isotonia. Sistem berkala unsur dikaitkan dengan rumusan saintifik yang ketat tentang masalah ramalan dalam , yang menunjukkan dirinya dalam ramalan kewujudan unsur yang tidak diketahui dan sifatnya, dan dalam ramalan ciri-ciri baru kelakuan kimia yang telah ditemui. elemen. Jadual berkala unsur ialah asas, terutamanya bukan organik; ia sangat membantu menyelesaikan masalah sintesis dengan sifat yang telah ditetapkan, pembangunan bahan baru, khususnya semikonduktor, pemilihan bahan khusus untuk pelbagai proses kimia, dsb. Jadual berkala unsur juga merupakan asas saintifik untuk pengajaran.
Lit.: Mendeleev D.I., Undang-undang berkala. Artikel asas, M., 1958; Kedrov B.M., Tiga aspek atomisme. Bahagian 3. Undang-undang Mendeleev, M., 1969; Rabinovich E., Tilo E., Jadual berkala unsur. Sejarah dan teori, M.-L., 1933; Karapetyants M. Kh., Drakin S. I., Stroenie, M., 1967; Astakhov K.V., Keadaan semasa sistem berkala D.I. Mendeleev, M., 1969; Kedrov B. M., Trifonov D. N., Undang-undang berkala dan. Penemuan dan kronologi, M., 1969; Seratus Tahun Undang-undang Berkala. Koleksi artikel, M., 1969; Seratus Tahun Undang-undang Berkala. Laporan pada sidang pleno, M., 1971; Spronsen J. W. van, Sistem berkala unsur kimia. Sejarah seratus tahun pertama, Amst.-L.-N.Y., 1969; Klechkovsky V.M., Taburan atom dan peraturan pengisian berurutan (n + l) kumpulan, M., 1968; Trifonov D.N., Mengenai tafsiran kuantitatif periodicity, M., 1971; Nekrasov B.V., Fundamentals, jilid 1-2, ed. ke-3, M., 1973; Kedrov B. M., Trifonov D. N., Mengenai masalah moden sistem berkala, M., 1974.
D. N. Trifonov.

nasi. 1. Jadual "Pengalaman sistem unsur" berdasarkan persamaan kimianya, disusun oleh D. I. Mendeleev pada 1 Mac 1869.

nasi. 3. Bentuk panjang jadual berkala unsur (versi moden).

nasi. 4. Bentuk tangga sistem berkala unsur (menurut N., 1921).

nasi. 2. "Sistem unsur semula jadi" oleh D. I. Mendeleev (bentuk pendek), diterbitkan dalam bahagian ke-2 edisi pertama Fundamentals pada tahun 1871.

Jadual berkala unsur oleh D. I. Mendeleev.
Sistem berkala unsur kimia ialah klasifikasi unsur kimia yang dicipta oleh D. I. Mendeleev berdasarkan undang-undang berkala yang ditemuinya pada tahun 1869.
D. I. Mendeleev
Menurut rumusan moden undang-undang ini, dalam satu siri berterusan unsur-unsur yang disusun mengikut magnitud peningkatan cas positif nukleus atom mereka, unsur-unsur dengan sifat yang serupa berulang secara berkala.
Jadual berkala unsur kimia, dibentangkan dalam bentuk jadual, terdiri daripada kala, siri dan kumpulan.
Pada permulaan setiap tempoh (kecuali yang pertama), unsur itu telah menyatakan sifat logam (logam alkali).

Simbol untuk jadual warna: 1 - tanda kimia unsur; 2 - nama; 3 - jisim atom (berat atom); 4 - nombor siri; 5 - pengagihan elektron merentasi lapisan.
Apabila nombor atom unsur meningkat, sama dengan cas positif nukleus atomnya, sifat logam secara beransur-ansur melemah dan sifat bukan logam meningkat. Unsur penultimate dalam setiap kala ialah unsur dengan sifat bukan logam (), dan yang terakhir ialah gas lengai. Dalam tempoh I terdapat 2 unsur, dalam II dan III - 8 unsur, dalam IV dan V - 18, dalam VI - 32 dan dalam VII (tempoh tidak lengkap) - 17 unsur.
Tiga tempoh pertama dipanggil tempoh kecil, setiap daripadanya terdiri daripada satu baris mendatar; selebihnya - dalam tempoh yang besar, setiap satunya (kecuali untuk tempoh VII) terdiri daripada dua baris mendatar - genap (atas) dan ganjil (bawah). Hanya logam terdapat dalam barisan genap tempoh yang besar. Sifat unsur dalam siri ini berubah sedikit dengan peningkatan nombor ordinal. Sifat unsur dalam baris ganjil tempoh besar berubah. Dalam tempoh VI, lanthanum diikuti oleh 14 unsur, sangat serupa dalam sifat kimia. Unsur-unsur ini, dipanggil lantanida, disenaraikan secara berasingan di bawah jadual utama. Actinides, unsur-unsur berikut actinium, dibentangkan sama dalam jadual.

Jadual mempunyai sembilan kumpulan menegak. Nombor kumpulan, dengan pengecualian yang jarang berlaku, adalah sama dengan valensi positif tertinggi bagi unsur kumpulan ini. Setiap kumpulan, tidak termasuk sifar dan kelapan, dibahagikan kepada subkumpulan. - utama (terletak di sebelah kanan) dan menengah. Dalam subkumpulan utama, apabila nombor atom bertambah, sifat logam unsur menjadi lebih kuat dan sifat bukan logam menjadi lemah.
Oleh itu, kimia dan beberapa sifat fizik unsur ditentukan oleh tempat yang diduduki unsur tertentu dalam jadual berkala.
Unsur biogenik, iaitu unsur yang merupakan sebahagian daripada organisma dan melaksanakan peranan biologi tertentu di dalamnya, menduduki bahagian atas jadual berkala. Sel yang diduduki oleh unsur yang membentuk sebahagian besar (lebih daripada 99%) bahan hidup berwarna biru; sel yang diduduki oleh unsur mikro berwarna merah jambu (lihat).
Jadual berkala unsur-unsur kimia adalah pencapaian terbesar sains semula jadi moden dan ekspresi jelas undang-undang dialektik alam yang paling umum.
Lihat juga, Berat atom.
Sistem berkala unsur kimia ialah klasifikasi semula jadi unsur kimia yang dicipta oleh D. I. Mendeleev berdasarkan undang-undang berkala yang ditemuinya pada tahun 1869.
Dalam rumusan asalnya, hukum berkala D.I. Mendeleev menyatakan: sifat unsur kimia, serta bentuk dan sifat sebatiannya, secara berkala bergantung pada berat atom unsur. Selepas itu, dengan perkembangan doktrin struktur atom, telah ditunjukkan bahawa ciri yang lebih tepat bagi setiap unsur bukanlah berat atom (lihat), tetapi nilai cas positif nukleus atom unsur itu, sama dengan nombor bersiri (atom) unsur ini dalam sistem berkala D. I. Mendeleev . Bilangan cas positif pada nukleus atom adalah sama dengan bilangan elektron yang mengelilingi nukleus atom, kerana atom secara keseluruhan adalah neutral elektrik. Berdasarkan data ini, hukum berkala dirumuskan seperti berikut: sifat unsur kimia, serta bentuk dan sifat sebatiannya, secara berkala bergantung pada magnitud cas positif nukleus atomnya. Ini bermakna bahawa dalam siri berterusan unsur-unsur yang disusun mengikut urutan peningkatan cas positif nukleus atomnya, unsur-unsur yang mempunyai sifat yang serupa akan berulang secara berkala.
Bentuk jadual jadual berkala unsur kimia dibentangkan dalam bentuk modennya. Ia terdiri daripada tempoh, siri dan kumpulan. Tempoh mewakili siri mendatar berturut-turut unsur-unsur yang disusun mengikut urutan peningkatan cas positif nukleus atomnya.
Pada permulaan setiap tempoh (kecuali yang pertama) terdapat unsur dengan sifat logam yang jelas (logam alkali). Kemudian, apabila nombor siri bertambah, sifat logam unsur-unsur secara beransur-ansur melemah dan sifat bukan logam meningkat. Unsur terakhir dalam setiap tempoh ialah unsur dengan sifat bukan logam yang jelas (halogen), dan yang terakhir ialah gas lengai. Tempoh pertama terdiri daripada dua unsur, peranan logam alkali dan halogen di sini dimainkan secara serentak oleh hidrogen. Tempoh II dan III merangkumi 8 unsur setiap satu, dipanggil tipikal oleh Mendeleev. Kala IV dan V mengandungi 18 unsur setiap satu, VI-32. Tempoh VII masih belum selesai dan diisi semula dengan unsur buatan buatan; Pada masa ini terdapat 17 elemen dalam tempoh ini. Tempoh I, II dan III dipanggil kecil, setiap daripadanya terdiri daripada satu baris mendatar, IV-VII adalah besar: mereka (kecuali VII) termasuk dua baris mendatar - genap (atas) dan ganjil (bawah). Dalam baris genap tempoh besar hanya terdapat logam, dan perubahan sifat unsur dalam baris dari kiri ke kanan dinyatakan dengan lemah.
Dalam siri ganjil tempoh besar, sifat unsur dalam siri berubah dengan cara yang sama seperti sifat unsur biasa. Dalam baris genap tempoh VI, selepas lantanum, terdapat 14 unsur [dipanggil lantanida (lihat), lantanida, unsur nadir bumi], serupa dalam sifat kimia kepada lantanum dan antara satu sama lain. Senarai mereka diberikan secara berasingan di bawah jadual.
Unsur-unsur berikut aktinium - aktinida (aktinoid) - disenaraikan secara berasingan dan disenaraikan di bawah jadual.
Dalam jadual berkala unsur kimia, sembilan kumpulan terletak secara menegak. Nombor kumpulan adalah sama dengan valensi positif tertinggi (lihat) unsur kumpulan ini. Pengecualian adalah fluorin (hanya boleh menjadi monovalen negatif) dan bromin (tidak boleh heptavalen); sebagai tambahan, kuprum, perak, emas boleh mempamerkan valensi lebih besar daripada +1 (Cu-1 dan 2, Ag dan Au-1 dan 3), dan daripada unsur-unsur kumpulan VIII, hanya osmium dan ruthenium mempunyai valensi +8. . Setiap kumpulan, kecuali yang kelapan dan sifar, dibahagikan kepada dua subkumpulan: yang utama (terletak di sebelah kanan) dan yang kedua. Subkumpulan utama termasuk unsur tipikal dan unsur jangka panjang, subkumpulan sekunder hanya merangkumi unsur jangka panjang dan, lebih-lebih lagi, logam.
Dari segi sifat kimia, unsur setiap subkumpulan kumpulan tertentu berbeza dengan ketara antara satu sama lain, dan hanya valensi positif tertinggi adalah sama untuk semua unsur kumpulan tertentu. Dalam subkumpulan utama, dari atas ke bawah, sifat logam unsur diperkukuh dan yang bukan logam dilemahkan (contohnya, fransium ialah unsur yang mempunyai sifat logam yang paling ketara, dan fluorin adalah bukan logam). Oleh itu, tempat unsur dalam sistem berkala Mendeleev (nombor ordinal) menentukan sifatnya, iaitu purata sifat unsur jiran secara menegak dan mendatar.
Sesetengah kumpulan unsur mempunyai nama khas. Oleh itu, unsur-unsur subkumpulan utama kumpulan I dipanggil logam alkali, kumpulan II - logam alkali tanah, kumpulan VII - halogen, unsur yang terletak di belakang uranium - transuranium. Unsur-unsur yang merupakan sebahagian daripada organisma, mengambil bahagian dalam proses metabolik dan mempunyai peranan biologi yang jelas dipanggil unsur biogenik. Kesemua mereka menduduki bahagian atas meja D.I. Mendeleev. Ini terutamanya O, C, H, N, Ca, P, K, S, Na, Cl, Mg dan Fe, yang membentuk sebahagian besar bahan hidup (lebih daripada 99%). Tempat yang diduduki oleh unsur-unsur ini dalam jadual berkala berwarna biru muda. Unsur biogenik, yang terdapat sangat sedikit dalam badan (dari 10 -3 hingga 10 -14%), dipanggil unsur mikro (lihat). Sel-sel sistem berkala, berwarna kuning, mengandungi mikroelemen, kepentingan pentingnya untuk manusia telah terbukti.
Menurut teori struktur atom (lihat Atom), sifat kimia unsur bergantung terutamanya pada bilangan elektron dalam kulit elektron terluar. Perubahan berkala dalam sifat unsur dengan peningkatan cas positif nukleus atom dijelaskan oleh pengulangan berkala struktur kulit elektron luar (tahap tenaga) atom.
Dalam tempoh yang kecil, dengan peningkatan dalam cas positif nukleus, bilangan elektron dalam petala luar meningkat daripada 1 kepada 2 dalam tempoh I dan dari 1 kepada 8 dalam tempoh II dan III. Oleh itu perubahan sifat unsur dalam tempoh daripada logam alkali kepada gas lengai. Kulit elektron luar, yang mengandungi 8 elektron, adalah lengkap dan stabil secara bertenaga (elemen kumpulan sifar adalah lengai secara kimia).
Dalam tempoh yang lama dalam baris genap, apabila cas positif nukleus meningkat, bilangan elektron dalam kulit luar kekal malar (1 atau 2) dan kulit luar kedua diisi dengan elektron. Oleh itu perubahan perlahan dalam sifat unsur dalam baris genap. Dalam siri ganjil tempoh besar, apabila cas nukleus meningkat, kulit luar diisi dengan elektron (dari 1 hingga 8) dan sifat unsur berubah dengan cara yang sama seperti unsur biasa.
Bilangan kulit elektron dalam atom adalah sama dengan nombor kala. Atom unsur subkumpulan utama mempunyai bilangan elektron dalam kulit terluarnya sama dengan nombor kumpulan. Atom unsur subkumpulan sampingan mengandungi satu atau dua elektron dalam kulit terluarnya. Ini menerangkan perbezaan sifat unsur-unsur subkumpulan utama dan sekunder. Nombor kumpulan menunjukkan kemungkinan bilangan elektron yang boleh mengambil bahagian dalam pembentukan ikatan kimia (valens) (lihat Molekul), oleh itu elektron tersebut dipanggil valens. Untuk unsur subkumpulan sampingan, bukan sahaja elektron petala luar adalah valensi, tetapi juga elektron kedua terakhir. Bilangan dan struktur kulit elektron ditunjukkan dalam jadual berkala unsur kimia yang disertakan.
Undang-undang berkala D.I. Mendeleev dan sistem berdasarkannya adalah sangat penting dalam sains dan amalan. Undang-undang dan sistem berkala adalah asas untuk penemuan unsur kimia baru, penentuan tepat berat atomnya, perkembangan doktrin struktur atom, penubuhan undang-undang geokimia taburan unsur dalam kerak bumi dan perkembangan idea moden tentang bahan hidup, yang komposisinya dan corak yang berkaitan dengannya adalah mengikut sistem berkala. Aktiviti biologi unsur-unsur dan kandungannya dalam badan juga sebahagian besarnya ditentukan oleh tempat yang mereka duduki dalam jadual berkala Mendeleev. Oleh itu, dengan peningkatan nombor siri dalam beberapa kumpulan, ketoksikan unsur meningkat dan kandungannya dalam badan berkurangan. Undang-undang berkala adalah ungkapan yang jelas dari undang-undang dialektik yang paling umum tentang perkembangan alam.