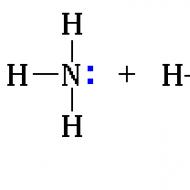Formula amina alifatik tepu. Sifat kimia amina. Tindak balas alkilasi anilin
Oleh kerana amina, sebagai derivatif ammonia, mempunyai struktur yang serupa dengannya (iaitu mereka mempunyai pasangan elektron tunggal dalam atom nitrogen), ia mempamerkan sifat yang serupa dengannya. Itu. amina, seperti ammonia, adalah bes kerana atom nitrogen boleh menyediakan pasangan elektron untuk membentuk ikatan dengan spesies kekurangan elektron melalui mekanisme penerima penderma (memenuhi takrifan keasaman Lewis).
I. Sifat amina sebagai bes (penerima proton)
1. Larutan akueus amina alifatik mempamerkan tindak balas alkali, kerana apabila mereka berinteraksi dengan air, alkil ammonium hidroksida terbentuk, serupa dengan ammonium hidroksida:
CH 3 NH 2 + H 2 O CH 3 NH 3 + + OH −


Aniline secara praktikal tidak bertindak balas dengan air.
Larutan akueus bersifat alkali:
Ikatan proton dengan amina, seperti ammonia, dibentuk oleh mekanisme penerima penderma disebabkan oleh pasangan elektron tunggal atom nitrogen.
Amina alifatik adalah bes yang lebih kuat daripada ammonia kerana radikal alkil meningkatkan ketumpatan elektron pada atom nitrogen disebabkan oleh + saya-kesan. Atas sebab ini, pasangan elektron atom nitrogen dipegang kurang erat dan berinteraksi dengan lebih mudah dengan proton.
2. Berinteraksi dengan asid, amina membentuk garam:
C 6 H 5 NH 2 + HCl → (C 6 H 5 NH 3) Cl
fenilamonium klorida

2CH 3 NH 2 + H 2 SO 4 → (CH 3 NH 3) 2 SO 4
metil ammonium sulfat
Garam amina ialah pepejal yang sangat larut dalam air dan kurang larut dalam cecair bukan kutub. Apabila bertindak balas dengan alkali, amina bebas dibebaskan:
Amina aromatik adalah bes yang lebih lemah daripada ammonia kerana pasangan elektron tunggal atom nitrogen dianjak ke arah cincin benzena, berkonjugasi dengan elektron π bagi cincin aromatik, yang mengurangkan ketumpatan elektron pada atom nitrogen (kesan-M). Sebaliknya, kumpulan alkil adalah penderma ketumpatan elektron yang baik (+I-kesan).
 atau
atau 

Penurunan ketumpatan elektron pada atom nitrogen membawa kepada penurunan keupayaan untuk mengabstrak proton daripada asid lemah. Oleh itu, aniline hanya berinteraksi dengan asid kuat (HCl, H 2 SO 4), dan larutan akueusnya tidak menjadikan litmus biru.
Atom nitrogen dalam molekul amina mempunyai sepasang elektron tunggal, yang boleh mengambil bahagian dalam pembentukan ikatan mengikut mekanisme penerima-penderma.
aniline ammonia amina primer amina sekunder amina tertier
ketumpatan elektron pada atom nitrogen meningkat.
Oleh kerana kehadiran sepasang elektron tunggal dalam molekul, amina, seperti ammonia, mempamerkan sifat asas.
anilin ammonia amina primer amina sekunder
sifat asas dipertingkatkan kerana pengaruh jenis dan bilangan radikal.
C6H5NH2< NH 3 < RNH 2 < R 2 NH < R 3 N (в газовой фазе)
II. Pengoksidaan amina
Amina, terutamanya yang aromatik, mudah teroksida di udara. Tidak seperti ammonia, mereka boleh menyala dari api terbuka. Amina aromatik secara spontan teroksida dalam udara. Oleh itu, anilin dengan cepat menjadi coklat di udara akibat pengoksidaan.
4СH 3 NH 2 + 9O 2 → 4CO 2 + 10H 2 O + 2N 2
4C 6 H 5 NH 2 + 31O 2 → 24CO 2 + 14H 2 O + 2N 2
III. Interaksi dengan asid nitrus
Asid nitrus HNO 2 ialah sebatian yang tidak stabil. Oleh itu, ia hanya digunakan pada masa pemilihan. HNO 2 terbentuk, seperti semua asid lemah, dengan tindakan garamnya (nitrit) dengan asid kuat:
KNO 2 + HCl → HNO 2 + KCl
atau NO 2 − + H + → HNO 2
Struktur produk tindak balas dengan asid nitrus bergantung kepada sifat amina. Oleh itu, tindak balas ini digunakan untuk membezakan antara amina primer, sekunder dan tertier.
· Amina alifatik primer membentuk alkohol dengan HNO 2:
R-NH 2 + HNO 2 → R-OH + N 2 + H 2 O
- Amat penting ialah tindak balas diazotisasi amina aromatik primer di bawah tindakan asid nitrus, yang diperolehi oleh tindak balas natrium nitrit dengan asid hidroklorik. Dan seterusnya fenol terbentuk:


· Amina sekunder (alifatik dan aromatik) di bawah pengaruh HNO 2 ditukar kepada terbitan N-nitroso (bahan dengan bau ciri):
R 2 NH + H-O-N=O → R 2 N-N=O + H 2 O
alkilnitrosamine
· Tindak balas dengan amina tertier membawa kepada pembentukan garam yang tidak stabil dan tidak mempunyai kepentingan praktikal.
IV. Ciri khas:
1. Pembentukan sebatian kompleks dengan logam peralihan:
2. Penambahan alkil halida Amina menambah haloalkana untuk membentuk garam:

Dengan merawat garam yang terhasil dengan alkali, anda boleh mendapatkan amina percuma:

V. Penggantian elektrofilik aromatik dalam amina aromatik (tindak balas anilin dengan air bromin atau asid nitrik):
Dalam amina aromatik, kumpulan amino memudahkan penggantian pada kedudukan orto dan para cincin benzena. Oleh itu, halogenasi aniline berlaku dengan cepat dan tanpa pemangkin, dan tiga atom hidrogen cincin benzena digantikan sekaligus, dan mendakan putih 2,4,6-tribromoaniline mendakan:

Tindak balas dengan air bromin ini digunakan sebagai tindak balas kualitatif untuk anilin.
Tindak balas ini (brominasi dan penitratan) kebanyakannya menghasilkan ortho- Dan sepasang- terbitan.
4. Kaedah untuk menghasilkan amina.
1. Reaksi Hoffmann. Salah satu kaedah pertama untuk menghasilkan amina primer ialah alkilasi ammonia dengan alkil halida:
Ini bukan kaedah terbaik, kerana hasilnya adalah campuran amina semua darjah penggantian:
dan lain-lain. Bukan sahaja alkil halida, tetapi juga alkohol boleh bertindak sebagai agen pengalkilasi. Untuk melakukan ini, campuran ammonia dan alkohol disalurkan ke atas aluminium oksida pada suhu tinggi.
2. Reaksi Zinin- cara mudah untuk mendapatkan amina aromatik dengan mengurangkan sebatian nitro aromatik. Berikut digunakan sebagai agen penurunan: H 2 (pada mangkin). Kadangkala hidrogen dijana secara langsung pada masa tindak balas, yang mana logam (zink, besi) dirawat dengan asid cair.

2HCl + Fe (cip) → FeCl 2 + 2H
C 6 H 5 NO 2 + 6[H] C 6 H 5 NH 2 + 2H 2 O.
Dalam industri, tindak balas ini berlaku apabila nitrobenzena dipanaskan dengan stim dengan kehadiran besi. Di makmal, hidrogen "pada saat pembebasan" dibentuk oleh tindak balas zink dengan alkali atau besi dengan asid hidroklorik. Dalam kes kedua, anilinium klorida terbentuk.
3. Pengurangan nitril. Gunakan LiAlH 4:
4. Dekarboksilasi enzimatik asid amino:

5. Penggunaan amina.
Amina digunakan dalam industri farmaseutikal dan sintesis organik (CH 3 NH 2, (CH 3) 2 NH, (C 2 H 5) 2 NH, dll.); dalam pengeluaran nilon (NH 2 -(CH 2) 6 -NH 2 - hexamethylenediamine); sebagai bahan mentah untuk penghasilan pewarna dan plastik (aniline), serta racun perosak.
Senarai sumber yang digunakan:
- O.S. Gabrielyan et al. Kimia. Darjah 10. Tahap profil: buku teks untuk institusi pendidikan am; Bustard, Moscow, 2005;
- "Tutor Kimia" disunting oleh A. S. Egorov; "Phoenix", Rostov-on-Don, 2006;
- G. E. Rudzitis, F. G. Feldman. Kimia darjah 10. M., Pendidikan, 2001;
- https://www.calc.ru/Aminy-Svoystva-Aminov.html
- http://www.yaklass.ru/materiali?mode=lsntheme&themeid=144
- http://www.chemel.ru/2008-05-24-19-21-00/2008-06-01-16-50-05/193-2008-06-30-20-47-29.html
- http://cnit.ssau.ru/organics/chem5/n232.htm
TOPIK KULIAH: AMINE DAN ALKOHOL AMINO
Soalan:
Ciri umum: struktur, klasifikasi, tatanama.
Kaedah penerimaan
Ciri-ciri fizikal
Sifat kimia
Wakil individu. Kaedah pengenalan.
Ciri umum: struktur, klasifikasi, tatanama
Amina ialah terbitan ammonia, molekulnya mempunyai atom hidrogen digantikan oleh radikal hidrokarbon.
Pengelasan
1– Amina dibezakan bergantung kepada bilangan atom hidrogen ammonia yang digantikan:
– utama mengandungi kumpulan amino kumpulan amino (–NH 2), formula am: R–NH 2,
– menengah mengandungi kumpulan imino (–NH),
formula am: R 1 –NH–R 2
– tertiari mengandungi atom nitrogen, formula am: R 3 –N
Sebatian dengan atom nitrogen kuartener juga dikenali: ammonium hidroksida kuaterner dan garamnya.
2– Bergantung pada struktur radikal, amina dibezakan:
- alifatik (tepu dan tak tepu)
– alisiklik
– aromatik (mengandungi kumpulan amino atau rantai sampingan dalam teras)
– heterosiklik.
Nomenklatur, isomerisme amina
1. Nama amina mengikut tatanama rasional biasanya berasal daripada nama radikal hidrokarbon konstituennya dengan penambahan pengakhiran. -amin : metilamina CH 3 –NH 2, dimetilamina CH 3 –NH–CH 3, trimetilamina (CH 3) 3 N, propylamine CH 3 CH 2 CH 2 –NH 2, phenylamine C 6 H 5 – NH 2, dsb.
2. Mengikut tatanama IUPAC, kumpulan amino dianggap sebagai kumpulan berfungsi dan namanya amino diletakkan sebelum nama rantai utama:
Isomerisme amina bergantung pada keisomerisme radikal.
Kaedah untuk menghasilkan amina
Amina boleh disediakan dalam pelbagai cara.
A) Tindakan ke atas ammonia oleh haloalkil
2NH 3 + CH 3 I ––® CH 3 – NH 2 + NH 4 I
B) Penghidrogenan katalitik nitrobenzena dengan hidrogen molekul:
C 6 H 5 NO 2 ––® C 6 H 5 NH 2 + H 2 O
nitrobenzena kucing aniline
B) Penyediaan amina rendah (C 1 – C 4) melalui pengalkilasi dengan alkohol:
350 0 C, Al 2 O 3
R–OH + NH 3 –––––––––––® R–NH 2 +H 2 O
350 0 C, Al 2 O 3
2R–OH + NH 3 –––––––––––® R 2 –NH +2H 2 O
350 0 C, Al 2 O 3
3R–OH + NH 3 –––––––––––® R 3 –N + 3H 2 O
Sifat fizikal amina
Methylamine, dimethylamine dan trimethylamine adalah gas, ahli tengah siri amina adalah cecair, dan ahli yang lebih tinggi adalah pepejal. Apabila berat molekul amina meningkat, ketumpatannya meningkat, takat didihnya meningkat, dan keterlarutannya dalam air berkurangan. Amina yang lebih tinggi tidak larut dalam air. Amina yang lebih rendah mempunyai bau yang tidak menyenangkan, agak mengingatkan bau ikan yang rosak. Amina yang lebih tinggi sama ada tidak berbau atau mempunyai bau yang sangat sedikit. Amina aromatik ialah cecair atau pepejal tidak berwarna yang mempunyai bau yang tidak menyenangkan dan beracun.
Sifat kimia amina
Kelakuan kimia amina ditentukan oleh kehadiran kumpulan amino dalam molekul. Terdapat 5 elektron dalam kulit elektron terluar atom nitrogen. Dalam molekul amina, sama seperti dalam molekul ammonia, atom nitrogen membelanjakan tiga elektron pada pembentukan tiga ikatan kovalen, manakala dua kekal bebas.
Kehadiran pasangan elektron bebas pada atom nitrogen memberikannya keupayaan untuk melekatkan proton, oleh itu amina adalah serupa dengan ammonia, mempamerkan sifat asas, membentuk hidroksida dan garam.
Pembentukan garam. Amina dengan asid memberikan garam, yang, di bawah pengaruh bes yang kuat, sekali lagi memberikan amina bebas:
Amina memberikan garam walaupun dengan asid karbonik lemah:
Seperti ammonia, amina mempunyai sifat asas kerana pengikatan proton menjadi kation ammonium tersubstitusi yang lemah tercerai:
| |
Apabila amina dilarutkan dalam air, sebahagian daripada proton air digunakan untuk membentuk kation; Oleh itu, lebihan ion hidroksida muncul dalam larutan, dan ia mempunyai sifat alkali yang mencukupi untuk mewarnakan larutan litmus biru dan phenolphthalein crimson. Keasaman amina siri pengehad berbeza-beza dalam had yang sangat kecil dan hampir dengan keasaman ammonia.
Kesan kumpulan metil meningkatkan sedikit keasaman metil dan dimetilamin. Dalam kes trimethylamine, kumpulan metil telah menghalang pelarutan kation yang terhasil dan mengurangkan penstabilannya, dan oleh itu keasasannya.
Garam amina harus dianggap sebagai sebatian kompleks. Atom pusat di dalamnya adalah atom nitrogen, nombor koordinasinya ialah empat. Atom hidrogen atau alkil terikat pada atom nitrogen dan terletak di dalam sfera; sisa asid terletak di sfera luar.
Asilasi amina. Apabila beberapa terbitan asid organik (asid halida, anhidrida, dsb.) bertindak ke atas amina primer dan sekunder, amida terbentuk:
Amina sekunder dengan asid nitrus memberi nitrosamin- cecair kekuningan, sedikit larut dalam air:
Amina tertier tahan terhadap tindakan asid nitrus cair dalam keadaan sejuk (ia membentuk garam asid nitrus); dalam keadaan yang lebih teruk, salah satu radikal terpecah dan nitrosoamine terbentuk.
Diamines
Diamines memainkan peranan penting dalam proses biologi. Sebagai peraturan, mereka mudah larut dalam air, mempunyai bau yang khas, mempunyai tindak balas yang sangat beralkali, dan berinteraksi dengan CO 2 di udara. Diamines membentuk garam yang stabil dengan dua asid yang setara.
Ethylenediamine (1,2-ethanediamine) H 2 NCH 2 CH 2 NH 2 . Ia adalah diamine yang paling mudah; boleh didapati dengan tindakan ammonia pada etilena bromida:
Tetramethylenediamine (1,4-butanediamine), atau putrescine, NH 2 CH 2 CH 2 CH 2 CH 2 NH 2 dan pentamethylenediamine (1,5-pentanediamine) NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2, atau kadaverin. Mereka ditemui dalam produk penguraian bahan protein; dibentuk oleh dekarboksilasi asid diamino dan dipanggil ptomanes(dari bahasa Yunani - mayat), mereka sebelum ini dianggap sebagai "racun kadaver". Kini telah didapati bahawa ketoksikan protein yang membusuk bukan disebabkan oleh ptomain, tetapi oleh kehadiran bahan lain.
Putrescine dan kadaverin terbentuk hasil daripada aktiviti penting banyak mikroorganisma (contohnya, agen penyebab tetanus dan taun) dan kulat; ia terdapat dalam keju, ergot, fly agaric, dan yis bir.
Beberapa diamina digunakan sebagai bahan mentah untuk penghasilan gentian poliamida dan plastik. Oleh itu, daripada hexa-methylenediamine NH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 NH 2 serat sintetik yang sangat berharga diperolehi - nilon(AS) atau anid(Rusia).
Alkohol amino
Alkohol amino- sebatian dengan fungsi bercampur, molekulnya mengandungi kumpulan amino dan hidroksi.
Aminoethanol(ethanolamine) HO-CH 2 CH 2 -NH 2, atau kolamin.
Etanolamin ialah cecair berminyak pekat, bercampur dengan air dalam semua aspek, dan mempunyai sifat alkali yang kuat. Bersama dengan monoethanolamine, dietanolamine dan triethanolamine juga diperoleh:
Kolin termasuk dalam lesitin- bahan seperti lemak, sangat biasa dalam organisma haiwan dan tumbuhan, dan boleh diasingkan daripadanya. Kolin adalah jisim kristal, sangat higroskopik yang mudah larut dalam udara. Ia mempunyai sifat alkali yang kuat dan mudah membentuk garam dengan asid.
Apabila kolin diasilasi dengan anhidrida asetik, ia terbentuk kolin asetat, juga dipanggil asetilkolin:
 |
Acetylcholine memainkan peranan biokimia yang sangat penting, kerana ia adalah perantara (mediator) yang menghantar pengujaan daripada reseptor saraf ke otot.
Berdasarkan sifat substituen hidrokarbon, amina dibahagikan kepada
Ciri-ciri struktur am amina
Sama seperti dalam molekul ammonia, dalam molekul mana-mana amina atom nitrogen mempunyai pasangan elektron tunggal yang diarahkan ke salah satu bucu tetrahedron terherot:
Atas sebab ini, amina, seperti ammonia, telah menyatakan sifat asas dengan ketara.
Oleh itu, amina, serupa dengan ammonia, bertindak balas secara terbalik dengan air, membentuk bes lemah:
Ikatan antara kation hidrogen dan atom nitrogen dalam molekul amina direalisasikan menggunakan mekanisme penerima penderma disebabkan oleh pasangan elektron tunggal atom nitrogen. Amina tepu adalah bes yang lebih kuat berbanding dengan ammonia, kerana dalam amina sedemikian, substituen hidrokarbon mempunyai kesan induktif (+I) positif. Dalam hal ini, ketumpatan elektron pada atom nitrogen meningkat, yang memudahkan interaksinya dengan kation H +.
Amina aromatik, jika kumpulan amino disambungkan terus ke cincin aromatik, mempamerkan sifat asas yang lebih lemah berbanding dengan ammonia. Ini disebabkan oleh fakta bahawa pasangan elektron tunggal atom nitrogen dialihkan ke arah sistem π aromatik cincin benzena, akibatnya ketumpatan elektron pada atom nitrogen berkurangan. Seterusnya, ini membawa kepada penurunan sifat asas, khususnya keupayaan untuk berinteraksi dengan air. Sebagai contoh, aniline hanya bertindak balas dengan asid kuat, tetapi praktikalnya tidak bertindak balas dengan air.
Sifat kimia amina tepu
Seperti yang telah disebutkan, amina bertindak balas secara terbalik dengan air:
Larutan berair amina mempunyai tindak balas beralkali kerana penceraian bes yang terhasil:
Amina tepu bertindak balas dengan air lebih baik daripada ammonia kerana sifat asasnya yang lebih kuat.
Sifat asas amina tepu meningkat dalam siri.
Amina tepu sekunder adalah bes yang lebih kuat daripada amina tepu primer, yang seterusnya adalah bes yang lebih kuat daripada ammonia. Bagi sifat asas amina tertier, jika kita bercakap tentang tindak balas dalam larutan akueus, maka sifat asas amina tertier dinyatakan jauh lebih buruk daripada amina sekunder, malah lebih teruk sedikit daripada amina primer. Ini disebabkan oleh halangan sterik, yang memberi kesan ketara kepada kadar protonasi amina. Dalam erti kata lain, tiga substituen "menyekat" atom nitrogen dan mengganggu interaksinya dengan kation H +.
Interaksi dengan asid
Kedua-dua amina tepu bebas dan larutan akueusnya bertindak balas dengan asid. Dalam kes ini, garam terbentuk:
Oleh kerana sifat asas amina tepu lebih ketara daripada ammonia, amina tersebut bertindak balas walaupun dengan asid lemah, seperti asid karbonik:
Garam amina ialah pepejal yang sangat larut dalam air dan kurang larut dalam pelarut organik bukan polar. Interaksi garam amina dengan alkali membawa kepada pembebasan amina bebas, serupa dengan anjakan ammonia apabila alkali bertindak ke atas garam ammonium:
2. Amina tepu primer bertindak balas dengan asid nitrus untuk membentuk alkohol, nitrogen N2 dan air yang sepadan. Sebagai contoh:
Ciri ciri tindak balas ini ialah pembentukan gas nitrogen, dan oleh itu ia adalah kualitatif untuk amina primer dan digunakan untuk membezakannya daripada yang sekunder dan tertier. Perlu diingatkan bahawa paling kerap tindak balas ini dilakukan dengan mencampurkan amina bukan dengan larutan asid nitrus itu sendiri, tetapi dengan larutan garam asid nitrus (nitrit) dan kemudian menambah asid mineral yang kuat kepada campuran ini. Apabila nitrit berinteraksi dengan asid mineral kuat, asid nitrus terbentuk, yang kemudiannya bertindak balas dengan amina:
Amina sekunder dalam keadaan yang sama memberikan cecair berminyak, yang dipanggil N-nitrosamines, tetapi tindak balas ini tidak berlaku dalam ujian PENGGUNAAN sebenar dalam kimia. Amina tertier tidak bertindak balas dengan asid nitrus.
Pembakaran lengkap mana-mana amina membawa kepada pembentukan karbon dioksida, air dan nitrogen:
Interaksi dengan haloalkana
Perlu diperhatikan bahawa garam yang sama diperolehi dengan tindakan hidrogen klorida pada amina yang lebih diganti. Dalam kes kami, apabila hidrogen klorida bertindak balas dengan dimetilamin:
Penyediaan amina:
1) Alkilasi ammonia dengan haloalkana:
Dalam kes kekurangan ammonia, garamnya diperolehi sebagai ganti amina:
2) Pengurangan oleh logam (kepada hidrogen dalam siri aktiviti) dalam persekitaran berasid:
diikuti dengan rawatan larutan dengan alkali untuk membebaskan amina bebas:
3) Tindak balas ammonia dengan alkohol apabila melepasi campurannya melalui aluminium oksida yang dipanaskan. Bergantung pada perkadaran alkohol/amin, amina primer, sekunder atau tertier terbentuk:
Sifat kimia aniline
Aniline - nama remeh untuk aminobenzena, mempunyai formula:
Seperti yang dapat dilihat dari ilustrasi, dalam molekul anilin kumpulan amino disambungkan secara langsung ke cincin aromatik. Amina sedemikian, seperti yang telah disebutkan, mempunyai sifat asas yang kurang jelas daripada ammonia. Oleh itu, khususnya, anilin secara praktikal tidak bertindak balas dengan air dan asid lemah seperti asid karbonik.
Tindak balas anilin dengan asid
Aniline bertindak balas dengan asid bukan organik kekuatan kuat dan sederhana. Dalam kes ini, garam phenylammonium terbentuk:
Tindak balas anilin dengan halogen
Seperti yang telah dinyatakan pada awal bab ini, kumpulan amino dalam amina aromatik ditarik ke dalam cincin aromatik, yang seterusnya mengurangkan ketumpatan elektron pada atom nitrogen, dan akibatnya meningkatkannya dalam cincin aromatik. Peningkatan ketumpatan elektron dalam cincin aromatik membawa kepada fakta bahawa tindak balas penggantian elektrofilik, khususnya tindak balas dengan halogen, berjalan dengan lebih mudah, terutamanya dalam kedudukan orto dan para berbanding dengan kumpulan amino. Oleh itu, anilin mudah bertindak balas dengan air bromin, membentuk mendakan putih 2,4,6-tribromoaniline:
Tindak balas ini adalah kualitatif untuk anilin dan selalunya membolehkan ia dikenal pasti antara sebatian organik lain.
Tindak balas anilin dengan asid nitrus
Aniline bertindak balas dengan asid nitrus, tetapi disebabkan kekhususan dan kerumitan tindak balas ini, ia tidak muncul dalam Peperiksaan Negeri Bersepadu yang sebenar dalam kimia.
Tindak balas alkilasi anilin
Menggunakan alkilasi berjujukan aniline pada atom nitrogen dengan hidrokarbon terhalogen, amina sekunder dan tertier boleh diperolehi:
Sifat kimia asid amino
Asid amino ialah sebatian yang molekulnya mengandungi dua jenis kumpulan berfungsi - kumpulan amino (-NH 2) dan karboksi- (-COOH).
Dalam erti kata lain, asid amino boleh dianggap sebagai derivatif asid karboksilik, dalam molekul yang mana satu atau lebih atom hidrogen digantikan oleh kumpulan amino.
Oleh itu, formula am asid amino boleh ditulis sebagai (NH 2) x R(COOH) y, di mana x dan y selalunya sama dengan satu atau dua.
Oleh kerana molekul asid amino mengandungi kedua-dua kumpulan amino dan kumpulan karboksil, ia mempamerkan sifat kimia yang serupa dengan kedua-dua amina dan asid karboksilik.
Sifat berasid asid amino
Pembentukan garam dengan alkali dan karbonat logam alkali
Pengesteran asid amino
Asid amino boleh bertindak balas dengan pengesteran dengan alkohol:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Sifat asas asid amino
1. Pembentukan garam apabila berinteraksi dengan asid
NH 2 CH 2 COOH + HCl → + Cl —
2. Interaksi dengan asid nitrus
NH 2 -CH 2 -COOH + HNO 2 → HO-CH 2 -COOH + N 2 + H 2 O
Nota: interaksi dengan asid nitrus berjalan dengan cara yang sama seperti amina primer
3. Alkilasi
NH 2 CH 2 COOH + CH 3 I → + I —
4. Interaksi asid amino antara satu sama lain
Asid amino boleh bertindak balas antara satu sama lain untuk membentuk peptida - sebatian yang mengandungi dalam molekulnya ikatan peptida –C(O)-NH-
Pada masa yang sama, perlu diperhatikan bahawa dalam kes tindak balas antara dua asid amino yang berbeza, tanpa memerhatikan beberapa keadaan sintesis tertentu, pembentukan dipeptida yang berbeza berlaku serentak. Jadi, sebagai contoh, bukannya tindak balas glisin dengan alanin di atas, yang membawa kepada glisilananin, tindak balas yang membawa kepada alanylglisin boleh berlaku:
Selain itu, molekul glisin tidak semestinya bertindak balas dengan molekul alanin. Tindak balas peptisasi juga berlaku antara molekul glisin:
Dan alanin:
Di samping itu, oleh kerana molekul peptida yang terhasil, seperti molekul asid amino asal, mengandungi kumpulan amino dan kumpulan karboksil, peptida itu sendiri boleh bertindak balas dengan asid amino dan peptida lain disebabkan oleh pembentukan ikatan peptida baru.
Asid amino individu digunakan untuk menghasilkan polipeptida sintetik atau dipanggil gentian poliamida. Oleh itu, khususnya, menggunakan polikondensasi asid 6-aminoheksana (ε-aminocaproic), nilon disintesis dalam industri:
Resin nilon yang terhasil digunakan untuk menghasilkan gentian tekstil dan plastik.
Pembentukan garam dalaman asid amino dalam larutan akueus
Dalam larutan akueus, asid amino wujud terutamanya dalam bentuk garam dalaman - ion bipolar (zwitterions).
Klasifikasi amina adalah berbeza-beza dan ditentukan oleh ciri struktur mana yang diambil sebagai asas.
Bergantung kepada bilangan kumpulan organik yang dikaitkan dengan atom nitrogen, terdapat:
amina primer satu kumpulan organik pada nitrogen RNH 2
amina sekunder dua kumpulan organik pada nitrogen R 2 NH, kumpulan organik boleh berbeza R "R" NH
amina tertier tiga kumpulan organik pada nitrogen R 3 N atau R"R"R""N
Berdasarkan jenis kumpulan organik yang dikaitkan dengan nitrogen, alifatik CH 3 N6H 5 N dibezakan
Berdasarkan bilangan kumpulan amino dalam molekul, amina dibahagikan kepada monoamina CH 3 NH 2, diamina H 2 N(CH 2) 2 NH 2, triamin, dll.
Nomenklatur amina.
perkataan "amina" ditambah kepada nama kumpulan organik yang dikaitkan dengan nitrogen, dan kumpulan tersebut disebut dalam susunan abjad, contohnya, CH 3 NHC 3 H 7 metilpropilamin, CH 3 N (C 6 H 5) 2 metildifenilamina. Peraturan juga membenarkan nama itu digubah berdasarkan hidrokarbon di mana kumpulan amino dianggap sebagai substituen. Dalam kes ini, kedudukannya ditunjukkan menggunakan indeks berangka: C 5 H 3 C 4 H 2 C 3 H(NH 2) C 2 H 2 C 1 H 3 3-aminopentane (indeks berangka biru atas menunjukkan susunan penomboran bagi atom C). Bagi sesetengah amina, nama remeh (dipermudahkan) telah dikekalkan: C 6 H 5 NH 2 anilin (nama mengikut peraturan tatanama ialah fenilamin).
Dalam sesetengah kes, nama yang telah ditetapkan digunakan, yang merupakan nama betul yang diherotkan: H 2 NCH 2 CH 2 OH monoethanolamine (2-aminoethanol dengan betul); (OHCH 2 CH 2) 2 NH dietanolamin, nama yang betul ialah bis(2-hydroxyethyl)amine. Nama yang remeh, diputarbelitkan dan sistematik (disusun mengikut peraturan tatanama) selalunya wujud bersama dalam kimia.
Sifat fizikal amina.
Wakil pertama siri amina metilamina CH 3 NH 2, dimetilamina (CH 3) 2 NH, trimetilamina (CH 3) 3 N dan etilamina C 2 H 5 NH 2 adalah gas pada suhu bilik, kemudian dengan peningkatan bilangan daripada atom dalam R, amina menjadi cecair, dan dengan pertambahan panjang rantai R hingga 10 C atom bahan kristal. Keterlarutan amina dalam air berkurangan apabila panjang rantai R meningkat dan bilangan kumpulan organik yang dikaitkan dengan nitrogen meningkat (peralihan kepada amina sekunder dan tertier). Bau amina menyerupai bau ammonia; amina yang lebih tinggi (dengan R besar) boleh dikatakan tidak berbau.
Sifat kimia amina.
Keupayaan tersendiri amina untuk melekatkan molekul neutral (contohnya, hidrogen halida HHal, dengan pembentukan garam organoammonium, serupa dengan garam ammonium dalam kimia tak organik. Untuk membentuk ikatan baharu, nitrogen menyediakan pasangan elektron tunggal, bertindak sebagai penderma. Proton H + yang terlibat dalam pembentukan ikatan (daripada hidrogen halida) memainkan peranan sebagai penerima (penerima), ikatan sedemikian dipanggil penerima-penderma (Rajah 1). Ikatan NH kovalen yang terhasil adalah setara sepenuhnya dengan ikatan NH yang terdapat dalam amina.
Amina tertier juga menambah HCl, tetapi apabila garam yang terhasil dipanaskan dalam larutan asid, ia terurai, dan R terbelah daripada atom N:
(C 2 H 5) 3 N+ HCl ® [(C 2 H 5) 3 N H]Cl
[(C 2 H 5) 3 N H]Cl ® (C 2 H 5) 2 N H + C 2 H 5 Cl
Apabila membandingkan kedua-dua tindak balas ini, adalah jelas bahawa kumpulan C 2 H 5 dan H kelihatan berubah tempat, akibatnya, amina sekunder terbentuk daripada amina tertier.
Melarutkan dalam air, amina menangkap proton dengan cara yang sama, akibatnya ion OH muncul dalam larutan, yang sepadan dengan pembentukan persekitaran alkali, yang boleh dikesan menggunakan penunjuk konvensional.
C2H5 N H 2 + H 2 O ® + + OH
Dengan pembentukan ikatan penderma-penerima, amina boleh menambah bukan sahaja HCl, tetapi juga haloalkil RCl, dengan itu membentuk ikatan NR baru, yang juga bersamaan dengan yang sedia ada. Jika kita mengambil amina tertier sebagai bahan permulaan, kita memperoleh garam tetraalkylammonium (empat kumpulan R pada satu atom N):
(C 2 H 5) 3 N+ C 2 H 5 I ® [(C 2 H 5) 4 N]Saya
Garam-garam ini, larut dalam air dan beberapa pelarut organik, terurai (terpecah), membentuk ion:
[(C 2 H 5) 4 N]I ® [(C 2 H 5) 4 N] + + Saya
Penyelesaian sedemikian, seperti semua larutan yang mengandungi ion, mengalirkan arus elektrik. Dalam garam tetraalkylammonium, halogen boleh digantikan dengan kumpulan H O:
[(CH 3) 4 N]Cl + AgOH ® [(CH 3) 4 N]OH + AgCl
Tetramethylammonium hydroxide yang terhasil ialah bes kuat dengan sifat yang serupa dengan alkali.
Amina primer dan sekunder bertindak balas dengan asid nitrus HON=O, tetapi mereka bertindak balas dengan cara yang berbeza. Alkohol primer terbentuk daripada amina primer:
C2H5 N H2+H N O 2 ® C 2 H 5 OH + N 2 +H 2 O
Tidak seperti amina primer, amina sekunder membentuk kuning, nitrosamin yang tidak larut dengan asid nitrus - sebatian yang mengandungi serpihan >NN = O:
(C 2 H 5) 2 N H+H N O 2 ® (C 2 H 5) 2 N N=O + H2O
Amina tertier tidak bertindak balas dengan asid nitrus pada suhu biasa, jadi asid nitrus ialah reagen yang membolehkan seseorang membezakan antara amina primer, sekunder dan tertier.
Apabila amina terkondensasi dengan asid karboksilik, amida asid terbentuk - sebatian dengan serpihan C(O)N
Pemeluwapan amina dengan aldehid dan keton membawa kepada pembentukan yang dipanggil bes Schiff - sebatian yang mengandungi serpihan N=C2.
Apabila amina primer berinteraksi dengan fosgen Cl 2 C=O, sebatian dengan kumpulan N=C=O terbentuk, dipanggil isosianat (Rajah 2D, penyediaan sebatian dengan dua kumpulan isosianat).
Antara amina aromatik, yang paling terkenal ialah anilin (fenilamina) C 6 H 5 NH 2. Sifatnya adalah serupa dengan amina alifatik, tetapi keasamannya kurang jelas; dalam larutan akueus ia tidak membentuk persekitaran alkali. Seperti amina alifatik, ia boleh membentuk garam ammonium [C 6 H 5 NH 3 ] + Cl dengan asid mineral kuat. Apabila anilin bertindak balas dengan asid nitrus (dengan kehadiran HCl), sebatian diazo yang mengandungi serpihan RN=N terbentuk, ia diperoleh dalam bentuk garam ionik yang dipanggil garam diazonium (Rajah 3A). Oleh itu, interaksi dengan asid nitrus tidak berjalan dengan cara yang sama seperti dalam kes amina alifatik. Cincin benzena dalam anilin mempunyai ciri kereaktifan sebatian aromatik ( cm. AROMATICITY), semasa halogenasi, atom hidrogen masuk ortho- Dan sepasang-kedudukan kepada kumpulan amino diganti, menghasilkan kloroanilin dengan tahap penggantian yang berbeza-beza (Rajah 3B). Tindakan asid sulfurik membawa kepada sulfonasi dalam sepasang-kedudukan kepada kumpulan amino, asid sulfanilik yang dipanggil terbentuk (Rajah 3B).
Penyediaan amina.
Apabila ammonia bertindak balas dengan haloalkil, seperti RCl, campuran amina primer, sekunder dan tertier terbentuk. Hasil sampingan HCl yang terhasil bergabung dengan amina untuk membentuk garam ammonium, tetapi jika terdapat lebihan ammonia, garam akan terurai, membolehkan proses itu diteruskan kepada pembentukan garam ammonium kuaternari (Rajah 4A). Tidak seperti alkil halida alifatik, aril halida, sebagai contoh, C 6 H 5 Cl, bertindak balas dengan ammonia dengan susah payah; sintesis hanya boleh dilakukan dengan pemangkin yang mengandungi kuprum. Dalam industri, amina alifatik diperoleh melalui interaksi pemangkin alkohol dengan NH 3 pada 300-500 ° C dan tekanan 1-20 MPa, menghasilkan campuran amina primer, sekunder dan tertier (Rajah 4B).
Apabila aldehid dan keton berinteraksi dengan garam ammonium asid formik HCOONH 4, amina primer terbentuk (Rajah 4C), dan tindak balas aldehid dan keton dengan amina primer (dengan kehadiran asid formik HCOOH) membawa kepada amina sekunder (Rajah 1). 4D).
Sebatian nitro (mengandungi kumpulan NO 2) apabila reduksi membentuk amina primer. Kaedah ini, yang dicadangkan oleh N.N. Zinin, sedikit digunakan untuk sebatian alifatik, tetapi penting untuk pengeluaran amina aromatik dan membentuk asas untuk pengeluaran industri anilin (Rajah 4D).
Amina jarang digunakan sebagai sebatian individu; contohnya, polyethylenepolyamine [-C 2 H 4 NH-] digunakan dalam kehidupan seharian. n(nama dagangan PEPA) sebagai pengeras untuk resin epoksi. Kegunaan utama amina adalah sebagai produk perantaraan dalam penyediaan pelbagai bahan organik. Peranan utama adalah aniline, berdasarkan mana pelbagai pewarna aniline dihasilkan, dan "pengkhususan" warna telah ditubuhkan pada peringkat mendapatkan aniline itu sendiri. Aniline ultra-tulen tanpa homolog dipanggil dalam industri "aniline untuk biru" (bermaksud warna pewarna masa depan). "Aniline untuk merah" mesti mengandungi, sebagai tambahan kepada aniline, campuran ortho- Dan sepasang-toluidine (CH 3 C 6 H 4 NH 2).
Diamine alifatik adalah sebatian permulaan untuk pengeluaran poliamida, contohnya, nilon (Rajah 2), yang digunakan secara meluas untuk pembuatan gentian, filem polimer, serta komponen dan bahagian dalam kejuruteraan mekanikal (gear poliamida).
Daripada diisosianat alifatik (Rajah 2) poliuretana diperoleh, yang mempunyai kompleks sifat penting dari segi teknikal: kekuatan tinggi digabungkan dengan keanjalan dan rintangan lelasan yang sangat tinggi (tapak kasut poliuretana), serta lekatan yang baik kepada pelbagai bahan (poliuretana). pelekat). Ia juga digunakan secara meluas dalam bentuk berbuih (buih poliuretana).
Ubat anti-radang sulfonamides disintesis berdasarkan asid sulfanilik (Rajah 3).
Garam diazonium (Rajah 2) digunakan dalam bahan fotosensitif untuk fotokopi, yang memungkinkan untuk mendapatkan imej yang memintas fotografi halida perak konvensional ( cm. MENYALIH HITAM).
Mikhail Levitsky
Amina - ini adalah terbitan ammonia (NH 3), dalam molekul yang mana satu, dua atau tiga atom hidrogen digantikan oleh radikal hidrokarbon.
Mengikut bilangan radikal hidrokarbon yang menggantikan atom hidrogen dalam molekul NH 3, semua amina boleh dibahagikan kepada tiga jenis:
Kumpulan - NH 2 dipanggil kumpulan amino. Terdapat juga amina yang mengandungi dua, tiga atau lebih kumpulan amino
Nomenklatur
Perkataan "amina" ditambah kepada nama sisa organik yang dikaitkan dengan nitrogen, dan kumpulan tersebut disebut dalam susunan abjad: CH3NC3H - methylpropylamine, CH3N(C6H5)2 - methyldiphenylamine. Untuk amina yang lebih tinggi, nama itu disusun menggunakan hidrokarbon sebagai asas, menambah awalan "amino", "diamino", "triamino", menunjukkan indeks berangka atom karbon. Untuk sesetengah amina, nama remeh digunakan: C6H5NH2 - aniline (nama sistematik - phenylamine).
Untuk amina, isomerisme rantai, isomerisme kedudukan kumpulan berfungsi, dan isomerisme antara jenis amina adalah mungkin
Ciri-ciri fizikal
Amina primer had rendah ialah bahan gas, mempunyai bau ammonia, dan sangat larut dalam air. Amina dengan berat molekul relatif yang lebih tinggi adalah cecair atau pepejal; keterlarutannya dalam air berkurangan dengan peningkatan berat molekul.
Sifat kimia
Amina mempunyai sifat kimia yang serupa dengan ammonia.
1. Interaksi dengan air - pembentukan ammonium hidroksida yang digantikan. Larutan ammonia dalam air mempunyai sifat alkali (asas) yang lemah. Sebab sifat asas ammonia ialah kehadiran pasangan elektron tunggal pada atom nitrogen, yang terlibat dalam pembentukan ikatan penerima penderma dengan ion hidrogen. Atas sebab yang sama, amina juga merupakan basa lemah. Amina ialah bes organik.
2. Interaksi dengan asid - pembentukan garam (tindak balas peneutralan). Sebagai bes, ammonia membentuk garam ammonium dengan asid. Begitu juga, apabila amina bertindak balas dengan asid, garam ammonium yang digantikan terbentuk. Alkali, sebagai bes yang lebih kuat, menyesarkan ammonia dan amina daripada garamnya.
3. Pembakaran amina. Amina ialah bahan mudah terbakar. Hasil pembakaran amina, seperti sebatian organik lain yang mengandungi nitrogen, ialah karbon dioksida, air dan nitrogen bebas.
Alkilasi ialah pengenalan substituen alkil ke dalam molekul sebatian organik. Agen pengalkilasi biasa ialah alkil halida, alkena, sebatian epoksi, alkohol, dan aldehid, keton, eter, sulfida, dan diazoalkana yang kurang biasa. Pemangkin alkilasi termasuk asid mineral, asid Lewis dan zeolit.
Asilasi. Apabila dipanaskan dengan asid karboksilik, anhidrida, asid klorida atau ester, amina primer dan sekundernya diasilasi untuk membentuk amida tersubstitusi N, sebatian dengan bahagian -C(O)N.<:

Tindak balas dengan anhidrida berlaku dalam keadaan ringan. Asid klorida bertindak balas dengan lebih mudah; tindak balas dijalankan dengan kehadiran bes untuk mengikat HCl yang terhasil.
Amina primer dan sekunder bertindak balas dengan asid nitrus dengan cara yang berbeza. Asid nitrus digunakan untuk membezakan amina primer, sekunder dan tertier antara satu sama lain. Alkohol primer terbentuk daripada amina primer:
C2H5NH2 + HNO2 → C2H5OH + N2 +H2O
Ini membebaskan gas (nitrogen). Ini adalah tanda bahawa terdapat amina primer dalam kelalang.
Amina sekunder membentuk kuning, nitrosamin kurang larut dengan asid nitrus - sebatian yang mengandungi serpihan >N-N=O:
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
Amina sekunder sukar dilepaskan; bau ciri nitrosodimethylamine merebak ke seluruh makmal.
Amina tertier hanya larut dalam asid nitrus pada suhu biasa. Apabila dipanaskan, tindak balas dengan penyingkiran radikal alkil adalah mungkin.
Kaedah mendapatkan
1. Interaksi alkohol dengan ammonia apabila dipanaskan dengan kehadiran Al 2 0 3 sebagai mangkin.
2. Interaksi alkil halida (haloalkana) dengan ammonia. Amina primer yang terhasil boleh bertindak balas dengan lebihan alkil halida dan ammonia untuk membentuk amina sekunder. Amina tertier boleh disediakan dengan cara yang sama
Asid amino. Klasifikasi, isomerisme, tatanama, pengeluaran. Sifat fizikal dan kimia. Sifat amfoterik, struktur bipolar, titik isoelektrik. Polipeptida. Wakil individu: glisin, alanin, sistein, sistin, asid a-aminocaproic, lisin, asid glutamat.
Asid amino- ini adalah terbitan hidrokarbon yang mengandungi kumpulan amino (-NH 2) dan kumpulan karboksil -COOH.
Formula am: (NH 2) f R(COOH) n di mana m dan n paling kerap sama dengan 1 atau 2. Oleh itu, asid amino ialah sebatian dengan fungsi bercampur.
Pengelasan

Isomerisme
Isomerisme asid amino, seperti asid hidroksi, bergantung kepada isomerisme rantai karbon dan pada kedudukan kumpulan amino berbanding karboksil. (a-, β - dan γ - asid amino, dsb.). Di samping itu, semua asid amino semulajadi, kecuali asid aminoacetic, mengandungi atom karbon asimetri, jadi ia mempunyai isomer optik (antipoda). Terdapat siri D- dan L asid amino. Perlu diingatkan bahawa semua asid amino yang membentuk protein tergolong dalam siri L.
Nomenklatur
Asid amino biasanya mempunyai nama remeh (contohnya, asid aminoasetik dipanggil secara berbeza glikol atau ais, dan asid aminopropionik - alanin dan lain-lain.). Nama asid amino mengikut tatanama sistematik terdiri daripada nama asid karboksilik yang sepadan yang mana ia adalah terbitan, dengan penambahan perkataan amino- sebagai awalan. Kedudukan kumpulan amino dalam rantai ditunjukkan oleh nombor.
Kaedah mendapatkan
1. Interaksi asid α-halokarboksilik dengan ammonia berlebihan. Semasa tindak balas ini, atom halogen dalam asid karboksilik terhalogen (untuk penyediaannya, lihat § 10.4) digantikan oleh kumpulan amino. Hidrogen klorida yang terhasil diikat oleh ammonia berlebihan untuk membentuk ammonium klorida.
2. Hidrolisis protein. Hidrolisis protein biasanya menghasilkan campuran kompleks asid amino, tetapi menggunakan kaedah khas, asid amino tulen individu boleh diasingkan daripada campuran ini.
Ciri-ciri fizikal
Asid amino ialah bahan kristal tidak berwarna, mudah larut dalam air, takat lebur 230-300°C. Banyak asid α-amino mempunyai rasa manis.
Sifat kimia

1. Interaksi dengan bes dan asid:
a) sebagai asid (kumpulan karboksil terlibat).
b) sebagai asas (kumpulan amino terlibat).
2. Interaksi di dalam molekul - pembentukan garam dalaman:
a) asid monoaminomonokarboksilik (asid neutral). Larutan akueus asid monoaminomonokarboksilik adalah neutral (pH = 7);
b) asid monoaminodikarboksilik (asid amino berasid). Larutan akueus asid monoaminodikarboksilik mempunyai pH< 7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н + ;
c) asid diaminomonokarboksilik (asid amino asas). Larutan akueus asid diaminomonokarboksilik mempunyai pH > 7 (persekitaran beralkali), kerana sebagai hasil daripada pembentukan garam dalaman asid ini, lebihan ion OH - hidroksida muncul dalam larutan.
3. Interaksi asid amino antara satu sama lain - pembentukan peptida.
4. Bertindak balas dengan alkohol untuk membentuk ester.
Titik isoelektrik asid amino yang tidak mengandungi kumpulan NH2 atau COOH tambahan ialah min aritmetik antara dua nilai pK: ![]() masing-masing untuk alanin
masing-masing untuk alanin ![]() .
.
Titik isoelektrik beberapa asid amino lain yang mengandungi kumpulan berasid atau asas tambahan (asid aspartik dan glutamat, lisin, arginin, tirosin, dll.) juga bergantung kepada keasidan atau keasaman radikal asid amino ini. Untuk lisin, sebagai contoh, pI harus dikira daripada separuh jumlah nilai pK untuk kumpulan α- dan ε-NH2. Oleh itu, dalam julat pH dari 4.0 hingga 9.0, hampir semua asid amino wujud terutamanya dalam bentuk zwitterion. dengan kumpulan amino terproton dan kumpulan karboksil tercerai.
Polipeptida mengandungi lebih daripada sepuluh sisa asid amino.
Glycine (asid aminoacetic, asid aminoethanoic) ialah asid amino alifatik yang paling ringkas, satu-satunya asid amino yang tidak mempunyai isomer optik. Formula empirik C2H5NO2
Alanine (asid aminopropanoik) ialah asid amino alifatik. α-alanine adalah sebahagian daripada banyak protein, β-alanine adalah sebahagian daripada beberapa sebatian aktif secara biologi. Formula kimia NH2 -CH -CH3 -COOH. Alanine mudah ditukar kepada glukosa dalam hati dan sebaliknya. Proses ini dipanggil kitaran glukosa-alanin dan merupakan salah satu laluan utama glukoneogenesis dalam hati.
Cysteine (asid α-amino-β-thiopropionic; 2-amino-3-sulfanylpropanoic acid) ialah asid amino yang mengandungi sulfur alifatik. Secara optik aktif, wujud dalam bentuk L- dan D-isomer. L-Cysteine adalah sebahagian daripada protein dan peptida dan memainkan peranan penting dalam pembentukan tisu kulit. Penting untuk proses detoksifikasi. Formula empirik C3H7NO2S.
Cystine (kimia) (3,3"-dithio-bis-2-asid aminopropionic, dicysteine) ialah asid amino yang mengandungi sulfur alifatik, hablur tidak berwarna, larut dalam air.
Cystine ialah asid amino tidak berkod yang merupakan hasil daripada dimerisasi oksidatif sistein, di mana dua kumpulan tiol sistein membentuk ikatan sistin disulfida. Cystine mengandungi dua kumpulan amino dan dua kumpulan karboksil dan merupakan asid diamino dibasic. Formula empirik C6H12N2O4S2
Di dalam badan mereka ditemui terutamanya dalam protein.
Asid aminocaproic (asid 6-aminohexanoic atau asid ε-aminocaproic) ialah ubat hemostatik yang menghalang penukaran profibrinolysin kepada fibrinolysin. kasar-
formula C6H13NO2.
Lysine (asid 2,6-diaminohexanoic) ialah asid amino alifatik dengan sifat asas yang jelas; asid amino penting. Formula kimia: C6H14N2O2
Lysine adalah sebahagian daripada protein. Lysine ialah asid amino penting, sebahagian daripada hampir mana-mana protein, yang diperlukan untuk pertumbuhan, pembaikan tisu, pengeluaran antibodi, hormon, enzim, albumin.
Asid glutamat (asid 2-aminopentanedioik) ialah asid amino alifatik. Dalam organisma hidup, asid glutamat dalam bentuk anion glutamat terdapat dalam protein, sejumlah bahan molekul rendah dan dalam bentuk bebas. Asid glutamat memainkan peranan penting dalam metabolisme nitrogen. Formula kimia C5H9N1O4
Asid glutamat juga merupakan asid amino neurotransmitter, salah satu wakil penting kelas "asid amino pengujaan". Pengikatan glutamat kepada reseptor neuron tertentu membawa kepada pengujaan yang terakhir.
Protein ringkas dan kompleks. Ikatan peptida. Konsep struktur primer, sekunder, tertier dan kuaternari bagi molekul protein. Jenis ikatan yang menentukan struktur spatial molekul protein (interaksi hidrogen, disulfida, ionik, hidrofobik). Sifat fizikal dan kimia protein (tindak balas pemendakan, tindak balas denaturasi, tindak balas warna). Titik isoelektrik. Maksud protein.
Protein - Ini adalah sebatian molekul tinggi semula jadi (biopolimer), asas strukturnya terdiri daripada rantai polipeptida yang dibina daripada residu asid α-amino.
Protein ringkas (protein) ialah bahan organik bermolekul tinggi yang terdiri daripada asid alfa-amino yang disambungkan dalam rantai oleh ikatan peptida.
Protein kompleks (proteid) ialah protein dua komponen yang, sebagai tambahan kepada rantai peptida (protein ringkas), mengandungi komponen bukan asid amino - kumpulan prostetik.
Ikatan peptida - sejenis ikatan amida yang berlaku semasa pembentukan protein dan peptida hasil daripada interaksi kumpulan α-amino (-NH2) satu asid amino dengan kumpulan α-karboksil (-COOH) asid amino yang lain.
Struktur primer ialah urutan asid amino dalam rantai polipeptida. Ciri penting struktur primer ialah motif terpelihara - gabungan asid amino yang memainkan peranan penting dalam fungsi protein. Motif yang dipelihara dipelihara sepanjang evolusi spesies dan selalunya boleh digunakan untuk meramalkan fungsi protein yang tidak diketahui.
Struktur sekunder ialah susunan tempatan serpihan rantai polipeptida, distabilkan oleh ikatan hidrogen.
Struktur tertier ialah struktur spatial rantai polipeptida (satu set koordinat spatial atom yang membentuk protein). Secara struktur, ia terdiri daripada elemen struktur sekunder yang distabilkan oleh pelbagai jenis interaksi, di mana interaksi hidrofobik memainkan peranan penting. Yang berikut mengambil bahagian dalam menstabilkan struktur tertier:
ikatan kovalen (antara dua sisa sistein - jambatan disulfida);
ikatan ionik antara kumpulan sisi bercas bertentangan sisa asid amino;
ikatan hidrogen;
interaksi hidrofilik-hidrofobik. Apabila berinteraksi dengan molekul air di sekeliling, molekul protein "cenderung" melipat supaya kumpulan sampingan nonpolar asid amino diasingkan daripada larutan akueus; kumpulan sampingan hidrofilik polar muncul pada permukaan molekul.
Struktur kuaterner (atau subunit, domain) - susunan relatif beberapa rantai polipeptida sebagai sebahagian daripada kompleks protein tunggal. Molekul protein yang membentuk protein dengan struktur kuaternari terbentuk secara berasingan pada ribosom dan hanya selepas selesai sintesis membentuk struktur supramolekul biasa. Protein dengan struktur kuaternari boleh mengandungi kedua-dua rantai polipeptida yang sama dan berbeza. Jenis interaksi yang sama mengambil bahagian dalam penstabilan struktur kuaternari seperti dalam penstabilan struktur tertier. Kompleks protein supramolekul boleh terdiri daripada berpuluh-puluh molekul.
Ciri-ciri fizikal
Ciri-ciri protein adalah pelbagai seperti fungsi yang mereka lakukan. Sesetengah protein larut dalam air, biasanya membentuk larutan koloid (contohnya, putih telur); yang lain larut dalam larutan garam cair; yang lain tidak larut (contohnya, protein tisu integumen).
Sifat kimia
Dalam radikal sisa asid amino, protein mengandungi pelbagai kumpulan berfungsi yang boleh memasuki banyak tindak balas. Protein menjalani tindak balas pengurangan pengoksidaan, pengesteran, pengalkilasi, penitratan, dan boleh membentuk garam dengan kedua-dua asid dan bes (protein adalah amfoterik).

Sebagai contoh, albumin - putih telur - pada suhu 60-70° mendakan daripada larutan (mengumpal), kehilangan keupayaannya untuk larut dalam air.