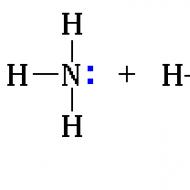Формула граничних аліфатичних амінів. Хімічні властивості амінів. Реакції алкілування аніліну
Так як аміни, будучи похідними аміаку, мають подібну з ним будову (тобто мають неподілену пару електронів в атомі азоту), то вони і виявляють подібні до нього властивості. Тобто. аміни, як і аміак, є основами, оскільки атом азоту може надавати електронну пару для утворення зв'язку з електронедостатніми частинками за донорно-акцепторним механізмом (відповідність визначенню основності за Льюїсом).
I. Властивості амінів як основ (акцепторів протонів)
1. Водні розчини аліфатичних амінів виявляють лужну реакцію, т.к. при їх взаємодії з водою утворюються гідроксиди алкіламонію, аналогічні гідроксиду амонію:
CH 3 NH 2 + H 2 O CH 3 NH 3 + + OH −


Анілін із водою практично не реагує.
Водні розчини мають лужний характер:
Зв'язок протона з аміном, як і з аміаком, утворюється за донорно-акцепторним механізмом за рахунок неподіленої електронної пари атома азоту.
Аліфатичні аміни – сильніші підстави, ніж аміак, т.к. алкільні радикали збільшують електронну густину на атомі азоту за рахунок + I-ефекту. Тому електронна пара атома азоту утримується менш міцно і легше взаємодіє з протоном.
2. Взаємодіючи з кислотами, аміни утворюють солі:
C 6 H 5 NH 2 + HCl → (C 6 H 5 NH 3)Cl
хлорид феніламонію

2CH 3 NH 2 + H 2 SO 4 → (CH 3 NH 3) 2 SO 4
сульфат метиламонію
Солі амінів – тверді речовини, добре розчинні у воді та погано розчинні у неполярних рідинах. При реакції з лугами виділяються вільні аміни:
Ароматичні аміни є більш слабкими основами, ніж аміак, оскільки неподілена електронна пара атома азоту зміщується у бік бензольного кільця, вступаючи в пару з π-електронами ароматичного ядра, що зменшує електронну щільність на атомі азоту (-М-ефект). Навпаки, алкільна група є добрим донором електронної щільності (+I-ефект).
 або
або 

Зменшення електронної густини на атомі азоту призводить до зниження здатності відщеплювати протони від слабких кислот. Тому анілін взаємодіє лише з сильними кислотами (HCl, H 2 SO 4), яке водний розчин не забарвлює лакмус в синій колір.
Атом азоту в молекулах амінів має неподілену пару електронів, яка може брати участь в утворенні зв'язку по донорно-акцепторному механізму.
анілін аміак первинний амін вторинний амін третинний амін
електронна густина на атомі азоту зростає.
Через наявність у молекулах неподіленої пари електронів аміни, як і аміак, виявляють основні властивості.
анілін аміак первинний амін вторинний амін
основні властивості посилюються, через вплив типу та числа радикалів.
C 6 H 5 NH 2< NH 3 < RNH 2 < R 2 NH < R 3 N (в газовой фазе)
ІІ. Окислення амінів
Аміни, особливо ароматичні, легко окислюються на повітрі. На відміну від аміаку, вони здатні спалахувати від відкритого полум'я. Ароматичні аміни мимоволі окислюються на повітрі. Так, анілін швидко буріє на повітрі внаслідок окислення.
4СH 3 NH 2 + 9O 2 → 4CO 2 + 10H 2 O + 2N 2
4C 6 H 5 NH 2 + 31O 2 → 24CO 2 + 14H 2 O + 2N 2
ІІІ. Взаємодія з азотистою кислотою
Азотиста кислота HNO 2 – нестійка сполука. Тому вона використовується лише у момент виділення. Утворюється HNO 2 як усі слабкі кислоти, дією на її сіль (нітрит) сильною кислотою:
KNO 2 + HCl → НNO 2 + KCl
або NO 2 − + H + → НNO 2
Будова продуктів реакції з азотистою кислотою залежить від характеру аміну. Тому дана реакція використовується для розрізнення первинних, вторинних та третинних амінів.
· Первинні аліфатичні аміни з HNO 2 утворюють спирти:
R-NH 2 + HNO 2 → R-OH + N 2 + H 2 O
- Величезне значення має реакція діазотування первинних ароматичних амінів під дією азотистої кислоти, одержуваної реакції нітриту натрію з соляною кислотою. А згодом утворюється фенол:


· Вторинні аміни (аліфатичні та ароматичні) під дією HNO 2 перетворюються на N-нітрозопохідні (речовини з характерним запахом):
R 2 NH + H-O-N = O → R 2 N-N = O + H 2 O
алкілнітрозамін
· Реакція з третинними амінами призводить до утворення нестійких солей та не має практичного значення.
IV. Особливі властивості:
1. Утворення комплексних з'єднань з перехідними металами:
2. Приєднання алкілгалогенідів Аміни приєднують галогеналкани з утворенням солі:

Обробляючи сіль лугом, можна отримати вільний амін:

V. Ароматичне електрофільне заміщення в ароматичних амінах (реакція аніліну з бромною водою або азотною кислотою):
В ароматичних амінах аміногрупа полегшує заміщення в орто-і пара-положеннях бензольного кільця. Тому галогенування аніліну відбувається швидко і відсутність каталізаторів, причому заміщаються відразу три атоми водню бензольного кільця, і випадає білий осад 2,4,6-триброманіліну:

Ця реакція бромної води використовується як якісна реакція на анілін.
У цих реакціях (бромування та нітрування) переважно утворюються орто- І пара-Похідні.
4. Способи одержання амінів.
1. Реакція Гофмана. Один з перших методів отримання первинних амінів - алкілування аміаку алкілгалогенідами:
Це не найкращий метод, тому що в результаті виходить суміш амінів всіх ступенів заміщення:
і т.д. Алкілуючі агенти можуть виступати не тільки алкілгалогеніди, але і спирти. Для цього суміш аміаку та спирту пропускають над оксидом алюмінію за високої температури.
2. Реакція Зініна- Зручний спосіб отримання ароматичних амінів при відновленні ароматичних нітросполук. Як відновники використовуються: H 2 (на каталізаторі). Іноді водень генерують безпосередньо в момент реакції, навіщо обробляють метали (цинк, залізо) розведеною кислотою.

2HCl + Fe (стружка) → FeCl 2 + 2H
C 6 H 5 NO 2 + 6[H] C 6 H 5 NH 2 + 2H 2 O.
У промисловості ця реакція протікає при нагріванні нітробензолу з водяною парою у присутності заліза. У лабораторії водень "у момент виділення" утворюється реакції цинку з лугом або заліза з соляною кислотою. В останньому випадку утворюється хлорид анілінію.
3. Відновлення нітрилів. Використовують LiAlH 4:
4. Ферментатичне декарбоксилювання амінокислот:

5. Застосування амінів.
Аміни застосовуються у фармацевтичній промисловості та органічному синтезі (CH 3 NH 2 , (CH 3) 2 NH, (C 2 H 5) 2 NH та ін.); при виробництві найлону (NH 2 -(CH 2) 6 -NH 2 - гексаметилендіамін); як сировина для виробництва барвників та пластмас (анілін), а також пестицидів.
Список використаних джерел:
- О.С. Габрієлян та ін. Хімія. 10 клас. Профільний рівень: підручник для загальноосвітніх установ; Дрофа, Москва, 2005 р.;
- «Репетитор з хімії» за редакцією А. С. Єгорова; "Фенікс", Ростов-на-Дону, 2006р;
- Р. Е. Рудзітіс, Ф. Г. Фельдман. Хімія 10 кл. М., Просвітництво, 2001;
- https://www.calc.ru/Aminy-Svoystva-Aminov.html
- http://www.yaklass.ru/materiali?mode=lsntheme&themeid=144
- http://www.chemel.ru/2008-05-24-19-21-00/2008-06-01-16-50-05/193-2008-06-30-20-47-29.html
- http://cnit.ssau.ru/organics/chem5/n232.htm
ТЕМА ЛЕКЦІЇ: АМІНИ ТА АМІНОСПИРТИ
Запитання:
Загальна характеристика: будова, номенклатура, класифікація.
Методи отримання
Фізичні властивості
Хімічні властивості
Окремі представники. Методи ідентифікації.
Загальна характеристика: будова, номенклатура, класифікація
Амінами називаються похідні аміаку, молекулою якого атоми водню заміщені на вуглеводневі радикали.
Класифікація
1– Залежно від кількості заміщених атомів водню аміаку розрізняють аміни:
– первиннімістять аміногрупу аміногрупу (–NH 2), загальна формула: R–NH 2 ,
– вториннімістять іміногрупу (-NH),
загальна формула: R 1 -NH-R 2
– третиннімістять атом азоту, загальна формула: R 3 -N
Відомі також сполуки з четвертинним атомом азоту: четвертинний гідроксид амонію та його солі.
2– Залежно від будови радикалу аміни розрізняють:
– аліфатичні (граничні та ненасичені)
- Аліциклічні
– ароматичні (які містять в ядрі аміногрупу або бічний ланцюг)
– гетероциклічні.
Номенклатура, ізомерія амінів
1. Назви амінів за раціональною номенклатурою зазвичай виробляють від назв вуглеводневих радикалів, що входять до них, з приєднанням закінчення -амін : метиламін СН 3 –NН 2 , диметиламін СН 3 –NН–СН 3 , триметиламін (СН 3) 3 N, пропіламін СН 3 СН 2 СН 2 –NН 2 , феніламін С 6 Н 5 – NН 2 і т.д.
2. За номенклатурою ІЮПАК аміногрупу розглядають як функціональну групу та її назву аміно-ставлять перед назвою основного ланцюга:
Ізомерія амінів залежить від ізомерії радикалів.
Способи одержання амінів
Аміни можуть бути отримані різними способами.
А) Дією на аміак галогеналкілами
2NH 3 + CH 3 I ––® CH 3 – NH 2 + NH 4 I
Б) Каталітичне гідрування нітробензолу молекулярним воднем:
С 6 Н 5 NО 2 ––® С 6 Н 5 NН 2 + Н 2 О
нітробензол кат анілін
В) Отримання нижчих амінів (С 1 -С 4) шляхом алкілування спиртами:
350 0 C, Al 2 O 3
R–OH + NH 3 –––––––––––® R–NH 2 +H 2 O
350 0 C, Al 2 O 3
2R–OH + NH 3 –––––––––––® R 2 –NH +2H 2 O
350 0 C, Al 2 O 3
3R–OH + NH 3 –––––––––––® R 3 –N + 3H 2 O
Фізичні властивості амінів
Метиламін, диметиламін та триметиламін – гази, середні члени ряду амінів – рідини, вищі – тверді тіла. Зі збільшенням молекулярної маси амінів збільшується їх щільність, підвищується температура кипіння та зменшується розчинність у воді. Вищі аміни у воді нерозчинні. Нижчі аміни мають неприємний запах, що трохи нагадує запах зіпсованої риби. Вищі аміни або не мають запаху, або мають дуже слабкий запах. Ароматичні аміни є безбарвними рідинами або твердими речовинами, що мають неприємний запах і отруйні.
Хімічні властивості амінів
Хімічна поведінка амінів визначається наявністю у молекулі аміногрупи. На зовнішній електронній оболонці атома азоту є 5 електронів. У молекулі аміну також, як і в молекулі аміаку, атом азоту витрачає на утворення трьох ковалентних зв'язків три електрони, а два залишаються вільними.
Наявність вільної електронної пари в атома азоту дає можливість приєднувати протон, тому аміни подібні аміаку, виявляють основні властивості, утворюють гідроксиди, солі.
Солеутворення. Аміни з кислотами дають солі, які під дією сильної основи знову дають вільні аміни:
Аміни дають солі навіть із слабкою вугільною кислотою:
Як і аміак, аміни володіють основними властивостями, що пояснюється зв'язуванням протонів у слабко дисоціюючий катіон заміщеного амонію:
| |
При розчиненні аміну у воді частина протонів води витрачається на утворення катіону; таким чином, у розчині з'являється надлишок гідроксид-іонів, і він має лужні властивості, достатні для фарбування розчинів лакмусу в синій колір та фенолфталеїну в малиновий. Основність амінів граничного ряду коливається в невеликих межах і близька до основності аміаку.
Ефект метильних груп дещо підвищує основність метил- та диметиламіну. У разі триметиламіну метильні групи вже ускладнюють сольватацію катіону, що утворюється, і зменшують його стабілізацію, а отже, і основність.
Солі амінів слід розглядати як комплексні сполуки. Центральним атомом у яких є атом азоту, координаційне число якого дорівнює чотирьом. Атоми водню або алкіли пов'язані з атомом азоту та розташовані у внутрішній сфері; кислотний залишок розташований у зовнішній сфері.
Ацилування амінів. При дії на первинні та вторинні аміни деяких похідних органічних кислот (галогенангідридів, ангідридів та ін.) утворюються аміди:
Вторинні аміни з азотистою кислотою дають нітрозоаміни- жовтуваті рідини, мало розчинні у воді:
Третинні аміни стійкі до дії розведеної азотистої кислоти на холоду (утворюють солі азотистої кислоти), у більш жорстких умовах один із радикалів відщеплюється та утворюється нітрозоамін.
Діаміни
Діаміни відіграють важливу роль у біологічних процесах. Як правило, вони легко розчиняються у воді, мають характерний запах, мають сильно лужну реакцію, взаємодіють з С0 2 повітря. Діаміни утворюють стійкі солі із двома еквівалентами кислоти.
Етилендіамін (1,2-етандіамін) H 2 NCH 2 СН 2 NН 2 . Він є найпростішим діаміном; може бути отриманий дією аміаку на етиленбромід:
Тетраметилендіамін (1,4-бутандіамін), або путресцин, NН 2 СН 2 СН 2 СН 2 СН 2 NH 2 та пентаметилендіамін (1,5-пентандіамін) NН 2 СН 2 СН 2 СН 2 СН 2 СН 2 NН 2 або кадаверин. Вони були відкриті у продуктах розкладання білкових речовин; утворюються при декарбоксилюванні діамінокислот і названі птомаїнами(від грецьк.- труп), їх вважали раніше «трупними отрутами». В даний час з'ясовано, що отруйність білків, що гниють, викликана не птомаїнами, а присутністю інших речовин.
Путресцин і кадаверин утворюються внаслідок життєдіяльності багатьох мікроорганізмів (наприклад, збудників правця та холери) та грибків; вони зустрічаються в сирі, ріжку, мухоморі, пивних дріжджах.
Деякі діаміни застосовуються як сировина для отримання поліамідних волокон та пластмас. Так, з гекса-метилендіаміну NН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 NН 2 отримано дуже цінне синтетичне волокно - найлон(США) або анід(Росія).
Аміноспирти
Аміноспирти- сполуки зі змішаними функціями, в молекулі яких містяться аміно- та оксигрупи.
Аміноетанол(Етаноламін) НО-СН 2 СН 2 -NH 2 або коламін.
Етаноламін - густа масляниста рідина, змішується з водою в усіх відношеннях, має сильні лужні властивості. Наряду з моноетаноламіном виходять також діетаноламін і триетаноламін:
Холін входить до складу лецитинів- жироподібних речовин, дуже поширених у тварин та рослинних організмах, і може бути виділений з них. Холін є кристалічною, дуже гігроскопічною, легко розпливається на повітрі масу. Він має сильні лужні властивості і з кислотами легко утворює солі.
При ацилюванні холіну оцтовим ангідридом утворюється холінацетат,званий також ацетилхолін:
 |
Ацетилхолін грає вкрай важливу біохімічну роль, оскільки є медіатором (посередником), що передає збудження нервових рецепторів до м'язів.
За характером вуглеводневих заступників аміни ділять на
Загальні особливості будови амінів
Також як і в молекулі аміаку, в молекулі будь-якого аміну атом азоту має неподілену електронну пару, спрямовану в одну з вершин спотвореного тетраедра:
Тому у амінів як і в аміаку істотно виражені основні властивості.
Так, аміни аналогічно аміаку оборотно реагують з водою, утворюючи слабкі підстави:
Зв'язок катіону водню з атомом азоту у молекулі аміну реалізується за допомогою донорно-акцепторного механізму за рахунок неподіленої електронної пари атома азоту. Граничні аміни є сильнішими підставами проти аміаком, т.к. в таких амінах вуглеводневі заступники мають позитивний індуктивний (+I) ефект. У зв'язку з цим на атомі азоту збільшується електронна щільність, що полегшує його взаємодію Космосу з катіоном Н + .
Ароматичні аміни, якщо аміногрупа безпосередньо з'єднана з ароматичним ядром, виявляють слабші основні властивості порівняно з аміаком. Пов'язано це з тим, що неподілена електронна пара атома азоту зміщується у бік ароматичної системи бензольного кільця внаслідок чого, електронна щільність на атомі азоту знижується. У свою чергу, це призводить до зниження основних властивостей, зокрема здатності взаємодіяти з водою. Так, наприклад, анілін реагує лише із сильними кислотами, а з водою практично не реагує.
Хімічні властивості граничних амінів
Як було зазначено, аміни оборотно реагують із водою:
Водні розчини амінів мають лужну реакцію середовища, внаслідок дисоціації основ, що утворюються:
Граничні аміни реагують з водою краще, ніж аміак, зважаючи на сильніші основні властивості.
Основні властивості граничних амінів збільшуються у ряду.
Вторинні граничні аміни є сильнішими основами, ніж первинні граничні, які є своєю чергою сильнішими основами, ніж аміак. Що стосується основних властивостей третинних амінів, то якщо йдеться про реакції у водних розчинах, то основні властивості третинних амінів виражені набагато гірше, ніж у вторинних амінів, і навіть трохи гірше ніж у первинних. Пов'язано це зі стеричними труднощами, які впливають на швидкість протонування аміну. Тобто три заступники «загороджують» атом азоту і заважають його взаємодії з катіонами H+.
Взаємодія з кислотами
Як вільні граничні аміни, і їх водні розчини вступають у взаємодію Космосу з кислотами. При цьому утворюються солі:
Оскільки основні властивості граничних амінів сильніше виражені, ніж у аміаку, такі аміни реагують навіть із слабкими кислотами, наприклад, вугільною:
Солі амінів є твердими речовинами, добре розчинними у воді і погано в неполярних органічних розчинниках. Взаємодія солей амінів з лугами призводить до вивільнення вільних амінів, аналогічно тому, як відбувається витіснення аміаку при дії лугів на солі амонію:
2. Первинні граничні аміни реагують з азотистою кислотою з утворенням відповідних спиртів, азоту N 2 та води. Наприклад:
Характерною ознакою даної реакції є утворення газоподібного азоту, у зв'язку з чим вона є якісною на первинні аміни і використовується для їхнього розрізнення від вторинних і третинних. Слід зазначити, що найчастіше цю реакцію проводять, змішуючи амін не з розчином азотистої кислоти, а з розчином солі азотистої кислоти (нітриту) і подальшим додаванням до цієї суміші сильної мінеральної кислоти. При взаємодії нітритів з сильними мінеральними кислотами утворюється азотиста кислота, яка потім реагує з аміном:
Вторинні аміни дають в аналогічних умовах маслянисті рідини, так звані N-нітрозамином, але дана реакція в реальних завданнях ЄДІ з хімії не зустрічається. Третичні аміни з азотистою кислотою не взаємодіють.
Повне згоряння будь-яких амінів призводить до утворення вуглекислого газу, води та азоту:
Взаємодія з галогеналканами
Примітно, що така сама сіль виходить при дії хлороводню на більш заміщений амін. У нашому випадку, при взаємодії хлороводню з диметиламіном:
Отримання амінів:
1) Алкілювання аміаку галогеналканами:
У разі нестачі аміаку замість аміну виходить його сіль:
2) Відновлення металами (до водню в ряду активності) у кислому середовищі:
з подальшою обробкою розчину лугом для вивільнення вільного аміну:
3) Реакція аміаку зі спиртами при пропущенні їх суміші через нагрітий оксид алюмінію. Залежно від пропорцій спирт/амін утворюються первинні, вторинні або третинні аміни:
Хімічні властивості аніліну
Анілін - тривіальна назва амінобензолу, що має формулу:
Як можна бачити з ілюстрації, у молекулі аніліну аміногрупа безпосередньо з'єднана з ароматичним кільцем. У таких амінів, як було зазначено, основні властивості виражені набагато слабше, ніж в аміаку. Так, зокрема, анілін практично не реагує з водою та слабкими кислотами типу вугільної.
Взаємодія аніліну з кислотами
Анілін реагує з сильними та середньої сили неорганічними кислотами. При цьому утворюються солі феніламонію:
Взаємодія аніліну з галогенами
Як вже було сказано на початку цієї глави, аміногрупа в ароматичних амінах, втягнута в ароматичне кільце, що у свою чергу знижує електронну щільність на атомі азоту, і як наслідок збільшує її в ароматичному ядрі. Збільшення електронної щільності в ароматичному ядрі призводить до того, що реакції електрофільного заміщення, зокрема, реакції з галогенами протікають значно легше, особливо в орто- та параположеннях щодо аміногрупи. Так, анілін з легкістю вступає у взаємодію з бромною водою, утворюючи білий осад 2,4,6-триброманіліну:
Ця реакція є якісною на анілін і часто дозволяє визначити його серед інших органічних сполук.
Взаємодія аніліну з азотистою кислотою
Анілін реагує з азотистою кислотою, але через специфічність і складність цієї реакції в реальному ЄДІ з хімії вона не зустрічається.
Реакції алкілування аніліну
За допомогою послідовного алкілування аніліну по атому азоту галогенпохідними вуглеводнів можна отримувати вторинні та третинні аміни:
Хімічні властивості амінокислот
Амінокислотами називають сполуки в молекулах яких є два типи функціональних груп – аміно (-NH 2) і карбокси- (-COOH) групи.
Іншими словами, амінокислоти можна розглядати як похідні карбонових кислот, у молекулах яких один або кілька атомів водню заміщені на аміногрупи.
Таким чином, загальну формулу амінокислот можна записати як (NH 2) x R(COOH) y , де x і y найчастіше дорівнюють одиниці або двом.
Оскільки в молекулах амінокислот є аміногрупа і карбоксильна група, вони виявляють хімічні властивості схожі як амінів, так і карбонових кислот.
Кислотні властивості амінокислот
Утворення солей з лугами та карбонатами лужних металів
Етерифікація амінокислот
Амінокислоти можуть вступати в реакцію етерифікації зі спиртами:
NH 2 CH 2 COOH + CH 3 OH → NH 2 CH 2 COOCH 3 + H 2 O
Основні властивості амінокислот
1. Утворення солей при взаємодії з кислотами
NH 2 CH 2 COOH + HCl → + Cl
2. Взаємодія з азотистою кислотою
NH 2 -CH 2 -COOH + HNO 2 → АЛЕ-CH 2 -COOH + N 2 + H 2 O
Примітка: взаємодія з азотистою кислотою протікає так само, як і з первинними амінами
3. Алкілювання
NH 2 CH 2 COOH + CH 3 I → + I
4. Взаємодія амінокислот один з одним
Амінокислоти можуть реагувати один з одним, утворюючи пептиди – сполуки, що містять у своїх молекулах пептидний зв'язок –C(O)-NH-
При цьому слід зазначити, що у разі проведення реакції між двома різними амінокислотами, без дотримання деяких специфічних умов синтезу, одночасно протікає утворення різних дипептидів. Так, наприклад, замість реакції гліцину з аланіном вище, що призводить до гліцилананіну, може відбутися реакція, що призводить до аланілгліцину:
Крім того, молекула гліцину не обов'язково реагує з молекулою аланіну. Протікають також реакції пептизації між молекулами гліцину:
І аланіна:
Крім цього, оскільки молекули пептидів, що утворюються, як і вихідні молекули амінокислот містять аміногрупи і карбоксильні групи, самі пептиди можуть реагувати з амінокислотами та іншими пептидами, завдяки утворенню нових пептидних зв'язків.
Окремі амінокислоти використовуються для синтетичних поліпептидів або так званих поліамідних волокон. Так, зокрема, за допомогою поліконденсації 6-аміногексанової (ε-амінокапронової) кислоти в промисловості синтезують капрон:
Отримана в результаті цієї реакції капронова смола використовується для виробництва текстильних волокон і пластмас.
Утворення внутрішніх солей амінокислот у водному розчині
У водних розчинах амінокислоти існують переважно у вигляді внутрішніх солей - біполярних іонів (цвіттер-іонів).
Класифікація амінів різноманітна і визначається тим, яку ознаку будови взято за основу.
Залежно від кількості органічних груп, пов'язаних з атомом азоту, розрізняють:
первинні аміни одна органічна група у азоту RNH 2
вторинні аміни дві органічних групи у азоту R 2 NH, органічні групи можуть бути різними R"R"NH
третинні аміни три органічних групи у азоту R 3 N або R"R"R""N
За типом органічної групи, пов'язаної з азотом, розрізняють аліфатичні СH 3 N6H 5 N
За кількістю аміногруп в молекулі аміни ділять на моноаміни СH 3 NH 2 , діаміни H 2 N(СH 2) 2 NН 2 , триаміни і т.д.
Номенклатура амінів.
до назви органічних груп, пов'язаних з азотом, додають слово «амін», при цьому групи згадують в алфавітному порядку, наприклад, СН 3 NHС 3 Н 7 метилпропіламін, СН 3 N(С 6 Н 5) 2 метилдифеніламін. Правила допускають також становити назву, взявши за основу вуглеводень, у якому аміногрупу розглядають як заступник. У такому разі її положення вказують за допомогою числового індексу: С 5 Н 3 С 4 Н 2 С 3 Н(NН 2)С 2 Н 2 С 1 Н 3 3-амінопентан (верхні числові індекси синього кольору вказують порядок нумерації атомів С) . Для деяких амінів збереглися тривіальні (спрощені) назви: З 6 Н 5 NH 2 анілін (назва за правилами номенклатури феніламін).
У деяких випадках застосовують усталені назви, які являють собою спотворені правильні назви: Н 2 NСН 2 СН 2 ВІН моноетаноламін (правильно 2-аміноетанол); (ОНСН 2 СН 2) 2 NH Діетаноламін, правильна назва біс(2-гідроксіетил)амін. Тривіальні, спотворені та систематичні (складені за правилами номенклатури) назви досить часто співіснують у хімії.
Фізичні властивості амінів.
Перші представники ряду амінів метиламін CH 3 NH 2 , диметиламін (CH 3) 2 NH, триметиламін (CH 3) 3 N і етиламін C 2 H 5 NH 2 при кімнатній температурі газоподібні, далі при збільшенні числа атомів в R аміни стають рідинами , а при збільшенні довжини ланцюга R до 10 атомів З кристалічними речовинами. Розчинність амінів у воді зменшується в міру збільшення довжини ланцюга R і при зростанні числа органічних груп, пов'язаних з азотом (перехід до вторинних та третинних амінів). Запах амінів нагадує запах аміаку, вищі (з великими R) аміни практично позбавлені запаху.
Хімічні властивості амінів.
Відмінна здатність амінів приєднувати нейтральні молекули (наприклад, галогеноводороди HHal, з утворенням органоамонієвих солей, подібних до амонійних солей у неорганічній хімії. Для утворення нового зв'язку азот надає неподілену електронну пару, виконуючи роль донора. відіграє роль акцептора (приймача), такий зв'язок називають донорно-акцепторним (рис. 1).
Третичні аміни також приєднують HCl, але при нагріванні отриманої солі в розчині кислоти вона розпадається, при цьому R відщеплюється від атома N:
(C 2 H 5) 3 N+ HCl ® [(C 2 H 5) 3 N H]Сl
[(C 2 H 5) 3 N H]Сl ® (C 2 H 5) 2 N H + C 2 H 5 Сl
При порівнянні цих двох реакцій видно, що C 2 H 5 -група і Н, як би міняються місцями, у результаті третинного аміну утворюється вторинний.
Розчиняючись у воді, аміни за такою ж схемою захоплюють протон, в результаті в розчині з'являються іони ВІН, що відповідає утворенню лужного середовища, його можна виявити за допомогою звичайних індикаторів.
C 2 H 5 N H 2 + H 2 O ® + + OH
З утворенням донорно-акцепторного зв'язку аміни можуть приєднувати не тільки HCl, а й галогеналкіли RCl, при цьому утворюється новий зв'язок NR, який також еквівалентний вже наявним. Якщо в якості вихідного взяти третинний амін, виходить сіль тетраалкіламонію (чотири групи R в одного атома N):
(C 2 H 5) 3 N+ C 2 H 5 I ® [(C 2 H 5) 4 N]I
Ці солі, розчиняючись у воді та деяких органічних розчинниках, дисоціюють (розпадаються), утворюючи іони:
[(C 2 H 5) 4 N]I ® [(C 2 H 5) 4 N] + + I |
Такі розчини, як і всі розчини, що містять іони, проводять електричний струм. У тетраалкіламонієвих солях можна замінити галоген НО-групою:
[(CH 3) 4 N]Cl + AgOH ® [(CH 3) 4 N]OH + AgCl
Гідроксид тетраметиламонію, що виходить, являє собою сильну основу, за властивостями близьку до лугів.
Первинні та вторинні аміни взаємодіють з азотистою кислотою HON=O, проте реагують вони по-різному. З первинних амінів утворюються первинні спирти:
C 2 H 5 N H 2 + H N O 2 ® C 2 H 5 OH + N 2 +H 2 O
На відміну від первинних, вторинні аміни утворюють з азотистою кислотою жовті, важко розчинні нітрозаміни сполуки, що містять фрагмент N = N:
(C 2 H 5) 2 N H+H N O 2 ® (C 2 H 5) 2 N N=O + H 2 O
Третичні аміни при звичайній температурі з азотистою кислотою не реагують, таким чином, азотиста кислота є реагентом, що дозволяє розрізнити первинні, вторинні та третинні аміни.
При конденсації амінів з карбоновими кислотами утворюються аміди кислот з'єднання з фрагментом С(О)N
Конденсація амінів з альдегідами і кетонами призводить до утворення так званих основ Шиффа з'єднань, що містять фрагмент N=C2.
При взаємодії первинних амінів з фосгеном Cl 2 С=O утворюються сполуки з угрупованням N=C=O, звані ізоціанатами (рис. 2Г, отримання з'єднання з двома ізоціанатними групами).
Серед ароматичних амінів найбільш відомий анілін (феніламін) 6 Н 5 NH 2 . За властивостями він близький до аліфатичних амінів, але його основність виражена слабше у водних розчинах він не утворює лужне середовище. Як і аліфатичні аміни, з сильними мінеральними кислотами він може утворювати солі амонієві [С 6 Н 5 NH 3 ] + Сl . При взаємодії аніліну з азотистою кислотою (у присутності HCl) утворюється діазосполука, що містить фрагмент R N = N, воно виходить у вигляді іонної солі, званої сіллю діазонію (рис. 3А). Таким чином, взаємодія з азотистою кислотою йде не так, як у разі аліфатичних амінів. Бензольне ядро в аніліні має реакційну здатність, характерну для ароматичних сполук ( см. АРОМАТИЧНІСТЬ), при галогенуванні атоми водню в орто- І пара-положення до аміногрупи заміщаються, виходять хлораніліни з різним ступенем заміщення (рис. 3Б). Дія сірчаної кислоти призводить до сульфування в пара-Положення до аміногрупи, утворюється так звана сульфанілова кислота (рис. 3В).
Отримання амінів.
При взаємодії аміаку з галогеналкілами, наприклад RCl, утворюється суміш первинних, вторинних та третинних амінів. Побічний продукт HCl, що утворюється, приєднується до амінів, утворюючи амонієву сіль, але при надлишку аміаку сіль розкладається, що дозволяє проводити процес аж до утворення четвертинних амонієвих солей (рис. 4А). На відміну від аліфатичних галогеналкілів, арилгалогеніди, наприклад, С 6 Н 5 Cl, реагують з аміаком насилу, синтез можливий тільки при каталізаторах, що містять мідь. У промисловості аліфатичні аміни отримують каталітичною взаємодією спиртів з NH 3 при 300?500° С і тиску 1?20 МПа, в результаті отримують суміш первинних, вторинних і третинних амінів (рис. 4Б).
При взаємодії альдегідів та кетонів з амонійною сіллю мурашиної кислоти HCOONH 4 утворюються первинні аміни (рис. 4В), а реакція альдегідів та кетонів з первинними амінами (у присутності мурашиної кислоти НСООН) призводить до вторинних амі.
Нітросполуки (що містять групу NO 2) при відновленні утворюють первинні аміни. Цей метод, запропонований Н. Н. Зініним, мало застосовується для аліфатичних сполук, але важливий для отримання ароматичних амінів і ліг в основу промислового виробництва аніліну (рис. 4Д).
Як окремі сполуки аміни застосовуються мало, наприклад, у побуті використовується поліетиленполіамін [-C 2 H 4 NH-] n(Торгове назва ПЕПА) як затверджувач епоксидних смол. Основне застосування амінів як проміжні продукти при отриманні різних органічних речовин. Провідна роль належить аніліну, на основі якого виробляється широкий спектр анілінових барвників, причому колірна спеціалізація закладається вже на стадії отримання самого аніліну. Надчистий анілін без домішки гомологів називають у промисловості «анілін для синього» (мається на увазі колір майбутнього барвника). «Анілін для червоного» повинен містити, крім аніліну, суміш орто- І пара-толуїдіна (СН 3 С 6 Н 4 NH 2).
Аліфатичні діаміни - вихідні сполуки для одержання поліамідів, наприклад, найлону (рис. 2), широко застосовуваного для виготовлення волокон, полімерних плівок, а також вузлів та деталей у машинобудуванні (поліамідні зубчасті передачі).
З аліфатичних діізоціанатів (рис. 2) отримують поліуретани, які мають комплекс технічно важливих властивостей: високою міцністю в поєднанні з еластичністю і дуже високим опором стирання (поліуретанові взуттєві підошви), а також гарною адгезією до широкого кола матеріалів (поліуретанові клеї). Широко їх застосовують і у спіненій формі (пінополіуретани).
На основі сульфанілової кислоти (рис. 3) синтезують протизапальні лікарські препарати сульфаніламіди.
Солі діазонію (рис. 2) застосовують у фоточутливих матеріалах для світлокопіювання, яке дозволяє отримувати зображення, минаючи звичайну галоїдосрібну фотографію ( см. СВІТКОПІРУВАННЯ).
Михайло Левицький
Аміни -це похідні аміаку (NH 3), в молекулі якого один, два або три атоми водню заміщені вуглеводневими радикалами.
За кількістю вуглеводневих радикалів, що заміщають атоми водню в молекулі NH 3 всі аміни можна розділити на три типи:
Група – NH 2 називається аміногрупою. Існують також аміни, які містять дві, три і більше аміногруп.
Номенклатура
До назви органічних залишків, пов'язаних з азотом, додають слово «амін», при цьому групи згадують в алфавітному порядку: CH3NC3H – метилпропіламін, CH3N(C6H5)2 – метилдифеніламін. Для вищих амінів назва складається, взявши за основу вуглеводень додаванням приставки «аміно», «діаміно», «тріаміно», вказуючи числовий індекс атома вуглецю. Для деяких амінів використовуються тривіальні назви: C6H5NH2 – анілін (систематична назва – феніламін).
Для амінів можлива ізомерія ланцюга, ізомерія положення функціональної групи, ізомерія між типами амінів
Фізичні властивості
Нижчі граничні первинні аміни – газоподібні речовини, мають запах аміаку, добре розчиняються у воді. Аміни з більшою відносною молекулярною масою - рідини або тверді речовини, їх розчинність у воді зі збільшенням молекулярної маси зменшується.
Хімічні властивості
За хімічними властивостями аміни нагадують аміак.
1. Взаємодія з водою – утворення гідроксидів заміщеного амонію. Розчин аміаку у воді має слабкі лужні (основні) властивості. Причина основних властивостей аміаку - наявність у атома азоту неподіленої електронної пари, яка бере участь у освіті донорно-акцепторного зв'язку з іоном водню. З цієї причини аміни також є слабкими підставами. Аміни – органічні основи.
2. Взаємодія з кислотами – утворення солей (реакції нейтралізації). Як основа аміак із кислотами утворює солі амонію. Аналогічно при взаємодії амінів із кислотами утворюються солі заміщеного амонію. Луги, як сильніші підстави, витісняють аміак та аміни з їх солей.
3. Горіння амінів. Аміни є горючими речовинами. Продуктами горіння амінів, як і інших азотовмісних органічних сполук, є вуглекислий газ, вода та вільний азот.
Алкілювання - введення алкільного замісника в молекулу органічної сполуки. Типовими алкілуючі агентами є алкілгалогеніди, алкени, епоксисполуки, спирти, рідше альдегіди, кетони, ефіри, сульфіди, діазоалкани. Каталізаторами алкілування є мінеральні кислоти, кислоти Льюїса і цеоліти.
Ацилювання. При нагріванні з карбоновими кислотами, їх ангідридами, хлорангідридами або складними ефірами первинні та вторинні аміни ацилюються з утворенням N-заміщених амідів, сполук із фрагментом -С(О)N<:

Реакція з ангідридами протікає у м'яких умовах. Ще легше реагують хлорангідриди, реакція проводиться в присутності основи, щоб зв'язати HCl, що утворюється.
Первинні та вторинні аміни взаємодіють з азотистою кислотою по-різному. За допомогою азотистої кислоти первинні, вторинні та третинні аміни відрізняють один від одного. З первинних амінів утворюються первинні спирти:
C2H5NH2 + HNO2 → C2H5OH + N2 + H2O
У цьому виділяється газ (азот). Це ознака того, що у колбі первинний амін.
Вторинні аміни утворюють з азотистою кислотою жовті, важко розчинні нітрозаміни - сполуки, що містять фрагмент >N-N=O:
(C2H5)2NH + HNO2 → (C2H5)2N-N=O + H2O
Вторинні аміни складно не впізнати, чи по лабораторії поширюється характерний запах нітрозодіметиламіну.
Третичні аміни при звичайній температурі азотистої кислоти просто розчиняються. При нагріванні можлива реакція із відщепленням алкільних радикалів.
Способи отримання
1.Взаємодія спиртів з аміаком при нагріванні в присутності Аl 2 0 3 як каталізатор.
2.Взаємодія алкілгалогенідів (галогеналканів) з аміаком. Первинний амін, що утворився, може вступати в реакцію з надлишком алкілгалогеніду і аміаку, в результаті чого утворюється вторинний амін. Аналогічно можуть бути отримані третинні аміни
амінокислоти. Класифікація, ізомерія, номенклатура, здобуття. Фізичні та хімічні властивості. Амфотерні властивості, біполярна структура, ізоелектрична точка. Поліпептиди. Окремі представники: гліцин, аланін, цистеїн, цистин, а-амінокапронова кислота, лізин, глутамінова кислота.
Амінокислоти- це похідні вуглеводнів, що містять аміногрупи (-NH 2) та карбоксильні групи -СООН.
Загальна формула: (NH 2) f R(COOH) n де m та n найчастіше дорівнюють 1 або 2. Таким чином, амінокислоти є сполуками зі змішаними функціями.
Класифікація

Ізомерія
Ізомерія амінокислот, як і гідроксикислот, залежить від ізомерії вуглецевого ланцюга та від положення аміногрупи по відношенню до карбоксилу (a-, β - та γ - амінокислоти і т.д.). Крім того, всі природні амінокислоти, крім амінооцтової, містять асиметричні атоми вуглецю, тому вони мають оптичні ізомери (антиподи). Розрізняють D-і L-ряди амінокислот. Слід зазначити, що всі амінокислоти, що входять до складу білків, належать до L-ряду.
Номенклатура
Амінокислоти зазвичай мають тривіальні назви (наприклад, амінооцтова кислота називається інакше глікоколомабо іїцином,а амінопропіонова кислота - аланіномі т.д.). Назва амінокислоти за систематичною номенклатурою складається з назви відповідної карбонової кислоти, похідною якої вона є, з додаванням як приставка слова аміно-. Положення аміногрупи в ланцюзі вказується цифрами.
Способи отримання
1.Взаємодія α-галогенкарбонових кислот з надлишком аміаку. У ході цих реакцій відбувається заміщення атома галогену в галогенкарбонових кислотах (про їх отримання див. § 10.4) на аміногрупу. Хлороводень, що вищеліється при цьому, зв'язується надлишком аміаку в хлорид амонію.
2.Гідроліз білків. При гідролізі білків зазвичай утворюються складні суміші амінокислот, проте за допомогою спеціальних методів цих сумішей можна виділяти окремі чисті амінокислоти.
Фізичні властивості
Амінокислоти - безбарвні кристалічні речовини, що добре розчиняються у воді, температура плавлення 230-300°С. Багато α-амінокислот мають солодкий смак.
Хімічні властивості

1. Взаємодія з основами та кислотами:
а) як кислота (бере участь карбоксильна група).
б) як основа (бере участь аміногрупа).
2. Взаємодія всередині молекули – утворення внутрішніх солей:
а) моноаміномонокарбонові кислоти (нейтральні кислоти). Водні розчини моноаміномонокарбонових кислот нейтральні (рН = 7);
б) моноамінодикарбонові кислоти (кислі амінокислоти). Водні розчини моноамінодикарбонових кислот мають рН< 7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н + ;
в) діаміномонокарбонові кислоти (основні амінокислоти). Водні розчини діаміномонокарбонових кислот мають рН > 7 (лужне середовище), оскільки в результаті утворення внутрішніх солей цих кислот у розчині з'являється надлишок гідроксид-іонів ВІН - .
3. Взаємодія амінокислот один з одним – утворення пептидів.
4. Взаємодіють зі спиртами із заснуванням складних ефірів.
Ізоелектрична точка амінокислот, що не містять додаткових NH2- або СООН-груп, є середнім арифметичним між двома значеннями рК": ![]() відповідно для аланіну
відповідно для аланіну ![]() .
.
Ізоелектрична точка ряду інших амінокислот, що містять додаткові кислотні або основні групи (аспарагінова та глутамінова кислоти, лізин, аргінін, тирозин та ін.), Залежить, крім того, від кислотності або основності радикалів цих амінокислот. Для лізину, наприклад, рI повинна обчислюватися з напівсуми значень рК для α- і ε-NН2-груп. Таким чином, в інтервалі рН від 4,0 до 9,0 майже всі амінокислоти існують переважно у формі цвіттеріонів з протонованої аміногрупою і дисоційованої карбоксильною групою.
Поліпептиди містять понад десять амінокислотних залишків.
Гліцин (амінооцтова кислота, аміноетанова кислота) - найпростіша аліфатична амінокислота, єдина амінокислота, яка не має оптичних ізомерів. Емпірична формула C2H5NO2
Аланін (амінопропанова кислота) – аліфатична амінокислота. α-аланін входить до складу багатьох білків, β-аланін - до складу ряду біологічно активних сполук. Хімічна формула NH2-CH-CH3-COOH. Аланін легко перетворюється на печінки на глюкозу і навпаки. Цей процес має назву глюкозо-аланінового циклу і є одним з основних шляхів глюконеогенезу в печінці.
Цистеїн (α-аміно-β-тіопропіонова кислота; 2-аміно-3-сульфанілпропанова кислота) - аліфатична сірковмісна амінокислота. Оптично активна, існує у вигляді L-і D-ізомерів. L-Цистеїн входить до складу білків та пептидів, відіграє важливу роль у процесах формування тканин шкіри. Має значення для дезінтоксикаційних процесів. Емпірична формула C3H7NO2S.
Цистін (хім.) (3,3"-дітіо-біс-2-амінопропіонова кислота, дицистеїн) - аліфатична сірковмісна амінокислота, безбарвні кристали, розчинні у воді.
Цистин - некодована амінокислота, що є продуктом окисної димеризації цистеїну, в ході якої дві тіольні групи цистеїну утворюють дисульфідний зв'язок цистину. Цистин містить дві аміногрупи та дві карбоксильні групи і відноситься до двоосновних діамінокислот. Емпірична формула C6H12N2O4S2
В організмі перебувають переважно у складі білків.
Амінокапронова кислота (6-аміногексанова кислота або ε-амінокапронова кислота) - лікарський гемостатичний засіб, що гальмує перетворення профібринолізину на фібринолізин. Брутто-
Формула C6H13NO2.
Лізин (2,6-діаміногексанова кислота) - аліфатична амінокислота з вираженими властивостями основи; незамінна амінокислота. Хімічна формула: C6H14N2O2
Лізин входить до складу білків. Лізин – це незамінна амінокислота, що входить до складу практично будь-яких білків, необхідна для зростання, відновлення тканин, виробництва антитіл, гормонів, ферментів, альбумінів.
Глутамінова кислота (2-амінопентандіова кислота) – аліфатична амінокислота. У живих організмах глутамінова кислота у вигляді аніону глутамату присутні у складі білків, низки низькомолекулярних речовин та у вільному вигляді. Глутамінова кислота відіграє у азотистому обміні. Хімічна формула C5H9N1O4
Глутамінова кислота також є нейромедіаторною амінокислотою, одним із важливих представників класу «збудливих амінокислот». Зв'язування глутамату зі специфічними рецепторами нейронів призводить до порушення останніх.
Прості та складні білки. Пептидна зв'язок. Поняття про первинну, вторинну, третинну і четвертинну структуру білкової молекули. Типи зв'язків, що визначають просторову будову молекули білка (водневі, дисульфідні, іонні, гідрофобні взаємодії). Фізичні та хімічні властивості білків (реакції осадження, денатурації, кольорові реакції). Ізоелектрична точка. Значення білків.
Білки -це природні високомолекулярні сполуки (біополімери), структурну основу яких складають поліпептидні ланцюги, побудовані із залишків α-амінокислот.
Прості білки (протеїни) - високомолекулярні органічні речовини, що складаються зі з'єднаних у ланцюжок пептидним зв'язком альфа-амінокислот.
Складні білки (протеїди) – двокомпонентні білки, в яких крім пептидних ланцюгів (простого білка) міститься компонент неамінокислотної природи – простетична група.
Пептидна зв'язок -вид амідного зв'язку, що виникає при утворенні білків і пептидів в результаті взаємодії α-аміногрупи (-NH2) однієї амінокислоти з α-карбоксильною групою (-СООН) іншої амінокислоти.
Первинна структура - послідовність амінокислот у поліпептидному ланцюзі. Важливими особливостями первинної структури є консервативні мотиви - поєднання амінокислот, які відіграють ключову роль функціях білка. Консервативні мотиви зберігаються у процесі еволюції видів, з них часто вдається передбачити функцію невідомого білка.
Вторинна структура – локальне впорядкування фрагмента поліпептидного ланцюга, стабілізоване водневими зв'язками.
Третинна структура – просторова будова поліпептидного ланцюга (набір просторових координат складових білок атомів). Структурно складається з елементів вторинної структури, стабілізованих різними типами взаємодій, у яких гідрофобні взаємодії грають найважливішу роль. У стабілізації третинної структури беруть участь:
ковалентні зв'язки (між двома залишками цистеїну - дисульфідні містки);
іонні зв'язки між протилежно зарядженими бічними групами амінокислотних залишків;
водневі зв'язки;
гідрофільно-гідрофобні взаємодії. При взаємодії з навколишніми молекулами води білкова молекула «прагне» звернутися так, щоб неполярні бічні групи амінокислот виявилися ізольованими від водного розчину; на поверхні молекули виявляються полярні гідрофільні бічні групи.
Четвертична структура (або субодинична, доменна) – взаємне розташування кількох поліпептидних ланцюгів у складі єдиного білкового комплексу. Білкові молекули, що входять до складу білка з четвертинною структурою, утворюються на рибосомах окремо і лише після закінчення синтезу утворюють загальну надмолекулярну структуру. До складу білка з четвертинною структурою можуть входити як ідентичні, так і поліпептидні ланцюжки, що розрізняються. У стабілізації четвертинної структури беруть участь самі типи взаємодій, що у стабілізації третинної. Надмолекулярні білкові комплекси можуть складатися із десятків молекул.
Фізичні властивості
Властивості білків також різноманітні, як і функції, які вони виконують. Одні білки розчиняються у воді, утворюючи, як правило, колоїдні розчини (наприклад, білок яйця); інші розчиняються у розведених розчинах солей; треті нерозчинні (наприклад, білки покривних тканин).
Хімічні властивості
У радикалах амінокислотних залишків білки містять різні функціональні групи, які здатні вступати до багатьох реакцій. Білки вступають у реакції окислення-відновлення, етерифікації, алкілування, нітрування, можуть утворювати солі як з кислотами, так і з основами (білки амфотерни).

Наприклад, альбумін - яєчний білок - при температурі 60-70 ° осаджується з розчину (згортається), втрачаючи здатність розчинятися у воді.