ವಿವಿಧ ಪರಿಸರದ ಕೋಷ್ಟಕದಲ್ಲಿನ ಸೂಚಕಗಳು. ಸೂಚಕಗಳು. ವಿವಿಧ ಪರಿಹಾರ ಪರಿಸರದಲ್ಲಿ ಸೂಚಕಗಳ ಬಣ್ಣ
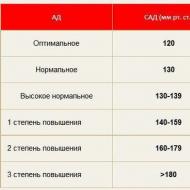
ಆಮ್ಲೀಯ ದ್ರಾವಣದಲ್ಲಿ pH< 7, в нейтральной среде рН = 7, в щелочной рН >7. ಕಡಿಮೆ pH, ಹೆಚ್ಚು ಆಮ್ಲೀಯ ದ್ರಾವಣ. pH ಮೌಲ್ಯಗಳು> 7 ನಲ್ಲಿ, ಪರಿಹಾರವನ್ನು ಕ್ಷಾರೀಯ ಎಂದು ಹೇಳಲಾಗುತ್ತದೆ.
ದ್ರಾವಣದ pH ಅನ್ನು ನಿರ್ಧರಿಸಲು ವಿವಿಧ ವಿಧಾನಗಳಿವೆ. ಪರಿಹಾರ ಪರಿಸರದ ಸ್ವರೂಪವನ್ನು ಸೂಚಕಗಳನ್ನು ಬಳಸಿಕೊಂಡು ಗುಣಾತ್ಮಕವಾಗಿ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ. ಸೂಚಕಗಳು ಪರಿಹಾರ ಪರಿಸರವನ್ನು ಅವಲಂಬಿಸಿ ತಮ್ಮ ಬಣ್ಣವನ್ನು ಹಿಮ್ಮುಖವಾಗಿ ಬದಲಾಯಿಸುವ ಪದಾರ್ಥಗಳಾಗಿವೆ. ಪ್ರಾಯೋಗಿಕವಾಗಿ, ಲಿಟ್ಮಸ್, ಮೀಥೈಲ್ ಕಿತ್ತಳೆ, ಫೀನಾಲ್ಫ್ಥಲೀನ್ ಮತ್ತು ಸಾರ್ವತ್ರಿಕ ಸೂಚಕವನ್ನು ಹೆಚ್ಚಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ (ಕೋಷ್ಟಕ 2).
ಕೋಷ್ಟಕ 2
ವಿವಿಧ ಪರಿಹಾರ ಪರಿಸರದಲ್ಲಿ ಸೂಚಕಗಳ ಬಣ್ಣ
pH ಮೌಲ್ಯವು ಔಷಧಕ್ಕೆ ಬಹಳ ಮುಖ್ಯವಾಗಿದೆ; ಸಾಮಾನ್ಯ ಮೌಲ್ಯಗಳಿಂದ 0.01 ಘಟಕಗಳ ವಿಚಲನವು ದೇಹದಲ್ಲಿನ ರೋಗಶಾಸ್ತ್ರೀಯ ಪ್ರಕ್ರಿಯೆಗಳನ್ನು ಸೂಚಿಸುತ್ತದೆ. ಸಾಮಾನ್ಯ ಆಮ್ಲೀಯತೆಯೊಂದಿಗೆ, ಗ್ಯಾಸ್ಟ್ರಿಕ್ ರಸವು pH = 1.7 ಅನ್ನು ಹೊಂದಿರುತ್ತದೆ; ಮಾನವ ರಕ್ತವು pH = 7.4; ಲಾಲಾರಸ - pH = 6.9.
ಅಯಾನು ವಿನಿಮಯ ಪ್ರತಿಕ್ರಿಯೆಗಳು ಮತ್ತು ಅವುಗಳ ಸಂಭವಿಸುವಿಕೆಗೆ ಷರತ್ತುಗಳು
ದ್ರಾವಣಗಳಲ್ಲಿನ ಎಲೆಕ್ಟ್ರೋಲೈಟ್ ಅಣುಗಳು ಅಯಾನುಗಳಾಗಿ ವಿಭಜನೆಯಾಗುವುದರಿಂದ, ಎಲೆಕ್ಟ್ರೋಲೈಟ್ ದ್ರಾವಣಗಳಲ್ಲಿನ ಪ್ರತಿಕ್ರಿಯೆಗಳು ಅಯಾನುಗಳ ನಡುವೆ ಸಂಭವಿಸುತ್ತವೆ. ಅಯಾನು ವಿನಿಮಯ ಪ್ರತಿಕ್ರಿಯೆಗಳು- ಇವು ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳ ವಿಘಟನೆಯ ಪರಿಣಾಮವಾಗಿ ರೂಪುಗೊಂಡ ಅಯಾನುಗಳ ನಡುವಿನ ಪ್ರತಿಕ್ರಿಯೆಗಳಾಗಿವೆ. ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯದ ರಚನೆಯ ಮೂಲಕ ಅಯಾನುಗಳನ್ನು ಬಂಧಿಸುವುದು ಅಂತಹ ಪ್ರತಿಕ್ರಿಯೆಗಳ ಮೂಲತತ್ವವಾಗಿದೆ. ಬೇರೆ ರೀತಿಯಲ್ಲಿ ಹೇಳುವುದಾದರೆ, ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳ (ಅವಕ್ಷೇಪ, ಅನಿಲ, H 2 O, ಇತ್ಯಾದಿ) ರಚನೆಗೆ ಕಾರಣವಾದರೆ ಅಯಾನು ವಿನಿಮಯ ಕ್ರಿಯೆಯು ಅರ್ಥಪೂರ್ಣವಾಗಿದೆ ಮತ್ತು ಬಹುತೇಕ ಪೂರ್ಣಗೊಳ್ಳುತ್ತದೆ. ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯವನ್ನು ರೂಪಿಸಲು ಪರಸ್ಪರ ಬಂಧಿಸುವ ದ್ರಾವಣದಲ್ಲಿ ಯಾವುದೇ ಅಯಾನುಗಳಿಲ್ಲದಿದ್ದರೆ, ಪ್ರತಿಕ್ರಿಯೆಯು ಹಿಂತಿರುಗಿಸಬಹುದಾಗಿದೆ; ಅಂತಹ ವಿನಿಮಯ ಪ್ರತಿಕ್ರಿಯೆಗಳಿಗೆ ಸಮೀಕರಣಗಳನ್ನು ಬರೆಯಲಾಗಿಲ್ಲ.
ಅಯಾನು ವಿನಿಮಯ ಪ್ರತಿಕ್ರಿಯೆಗಳನ್ನು ರೆಕಾರ್ಡ್ ಮಾಡುವಾಗ, ಆಣ್ವಿಕ, ಪೂರ್ಣ ಅಯಾನಿಕ್ ಮತ್ತು ಸಂಕ್ಷಿಪ್ತ ಅಯಾನಿಕ್ ರೂಪಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ. ಅಯಾನು ವಿನಿಮಯ ಪ್ರತಿಕ್ರಿಯೆಯನ್ನು ಮೂರು ರೂಪಗಳಲ್ಲಿ ಬರೆಯುವ ಉದಾಹರಣೆ:
K 2 SO 4 + BaCl 2 = BaSO 4 + 2KCl,
2K + + SO 4 2– + Ba 2+ + 2Cl – = BaSO 4 + 2K + + 2Cl – ,
Ba 2+ + SO 4 2– = BaSO 4 .
ಅಯಾನಿಕ್ ಪ್ರತಿಕ್ರಿಯೆಗಳ ಸಮೀಕರಣಗಳನ್ನು ರಚಿಸುವ ನಿಯಮಗಳು
1. ದುರ್ಬಲ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳ ಸೂತ್ರಗಳನ್ನು ಆಣ್ವಿಕ ರೂಪದಲ್ಲಿ ಮತ್ತು ಬಲವಾದ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳ ಸೂತ್ರಗಳನ್ನು ಅಯಾನಿಕ್ ರೂಪದಲ್ಲಿ ಬರೆಯಲಾಗುತ್ತದೆ.
2. ಪ್ರತಿಕ್ರಿಯೆಗಳಿಗೆ, ಪದಾರ್ಥಗಳ ಪರಿಹಾರಗಳನ್ನು ತೆಗೆದುಕೊಳ್ಳಲಾಗುತ್ತದೆ, ಆದ್ದರಿಂದ ಕಾರಕಗಳ ಸಂದರ್ಭದಲ್ಲಿ ಸ್ವಲ್ಪ ಕರಗುವ ಪದಾರ್ಥಗಳನ್ನು ಅಯಾನುಗಳ ರೂಪದಲ್ಲಿ ಬರೆಯಲಾಗುತ್ತದೆ.
3. ಪ್ರತಿಕ್ರಿಯೆಯ ಪರಿಣಾಮವಾಗಿ ಸ್ವಲ್ಪ ಕರಗುವ ವಸ್ತುವು ರೂಪುಗೊಂಡರೆ, ನಂತರ ಅಯಾನಿಕ್ ಸಮೀಕರಣವನ್ನು ಬರೆಯುವಾಗ ಅದನ್ನು ಕರಗುವುದಿಲ್ಲ ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ.
4. ಸಮೀಕರಣದ ಎಡಭಾಗದಲ್ಲಿರುವ ಅಯಾನು ಚಾರ್ಜ್ಗಳ ಮೊತ್ತವು ಬಲಭಾಗದಲ್ಲಿರುವ ಅಯಾನು ಶುಲ್ಕಗಳ ಮೊತ್ತಕ್ಕೆ ಸಮನಾಗಿರಬೇಕು.
ವಿಷಯದ ಮೇಲೆ ಪರೀಕ್ಷೆ “ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯ ವಿಘಟನೆಯ ಸಿದ್ಧಾಂತ. ಅಯಾನು ವಿನಿಮಯ ಪ್ರತಿಕ್ರಿಯೆಗಳು"
1. ಮೆಗ್ನೀಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಅನ್ನು ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದಲ್ಲಿ ಕರಗಿಸಿದಾಗ ಉಂಟಾಗುವ ಪ್ರತಿಕ್ರಿಯೆಯನ್ನು ಸಂಕ್ಷಿಪ್ತ ಅಯಾನಿಕ್ ಸಮೀಕರಣದಿಂದ ವಿವರಿಸಲಾಗಿದೆ:
a) Mg 2+ + SO 4 2– = MgSO 4;
ಬಿ) H + + OH - = H 2 O;
ಸಿ) Mg(OH) 2 + 2H + = Mg 2+ + 2H 2 O;
d) Mg(OH) 2 + SO 4 2– = MgSO 4 + 2OH –.
2. ನಾಲ್ಕು ಪಾತ್ರೆಗಳು ಕೆಳಗೆ ಪಟ್ಟಿ ಮಾಡಲಾದ ಪದಾರ್ಥಗಳ ಒಂದು ಲೀಟರ್ 1M ದ್ರಾವಣಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಯಾವ ದ್ರಾವಣವು ಹೆಚ್ಚು ಅಯಾನುಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ?
ಎ) ಪೊಟ್ಯಾಸಿಯಮ್ ಸಲ್ಫೇಟ್; ಬಿ) ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್;
ಸಿ) ಫಾಸ್ಪರಿಕ್ ಆಮ್ಲ; ಡಿ) ಈಥೈಲ್ ಆಲ್ಕೋಹಾಲ್.
3. ವಿಘಟನೆಯ ಮಟ್ಟವು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ:
ಎ) ಪರಿಹಾರದ ಪರಿಮಾಣ; ಬಿ) ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯದ ಸ್ವರೂಪ;
ಸಿ) ದ್ರಾವಕ; ಡಿ) ಸಾಂದ್ರತೆಗಳು.
4. ಸಂಕ್ಷಿಪ್ತ ಅಯಾನಿಕ್ ಸಮೀಕರಣ
Al 3+ + 3OH – = Al(OH) 3
ಪರಸ್ಪರ ಕ್ರಿಯೆಗೆ ಅನುರೂಪವಾಗಿದೆ:
ಎ) ನೀರಿನೊಂದಿಗೆ ಅಲ್ಯೂಮಿನಿಯಂ ಕ್ಲೋರೈಡ್;
ಬಿ) ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ನೊಂದಿಗೆ ಅಲ್ಯೂಮಿನಿಯಂ ಕ್ಲೋರೈಡ್;
ಸಿ) ನೀರಿನೊಂದಿಗೆ ಅಲ್ಯೂಮಿನಿಯಂ;
ಡಿ) ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ನೊಂದಿಗೆ ಅಲ್ಯೂಮಿನಿಯಂ.
5. ಹಂತ ಹಂತವಾಗಿ ಬೇರ್ಪಡಿಸದ ಎಲೆಕ್ಟ್ರೋಲೈಟ್:
ಎ) ಮೆಗ್ನೀಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್; ಬಿ) ಫಾಸ್ಪರಿಕ್ ಆಮ್ಲ;
ಸಿ) ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್; ಡಿ) ಸೋಡಿಯಂ ಸಲ್ಫೇಟ್
6. ದುರ್ಬಲ ಎಲೆಕ್ಟ್ರೋಲೈಟ್:
a) ಬೇರಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್;
ಬಿ) ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್;
ಸಿ) ಹೈಡ್ರೋಫ್ಲೋರಿಕ್ ಆಮ್ಲ;
ಡಿ) ಹೈಡ್ರೊಆಡಿಕ್ ಆಮ್ಲ
7. ಬರೈಟ್ ನೀರು ಮತ್ತು ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಾಗಿ ಸಣ್ಣ ಅಯಾನಿಕ್ ಸಮೀಕರಣದಲ್ಲಿನ ಗುಣಾಂಕಗಳ ಮೊತ್ತವು ಇದಕ್ಕೆ ಸಮಾನವಾಗಿರುತ್ತದೆ:
a) 6; ಬಿ) 4; ಸಿ) 7; ಡಿ) 8.
8. ಕೆಳಗಿನ ಜೋಡಿ ಪದಾರ್ಥಗಳು ದ್ರಾವಣದಲ್ಲಿ ಇರಬಾರದು:
ಎ) ತಾಮ್ರದ ಕ್ಲೋರೈಡ್ ಮತ್ತು ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್;
ಬಿ) ಪೊಟ್ಯಾಸಿಯಮ್ ಕ್ಲೋರೈಡ್ ಮತ್ತು ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್;
ಸಿ) ಹೈಡ್ರೋಕ್ಲೋರಿಕ್ ಆಮ್ಲ ಮತ್ತು ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್;
ಡಿ) ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ ಮತ್ತು ಬೇರಿಯಮ್ ಕ್ಲೋರೈಡ್.
9. ನೀರಿಗೆ ಸೇರಿಸುವ ವಸ್ತುವು ಅದರ ವಿದ್ಯುತ್ ವಾಹಕತೆಯನ್ನು ಬದಲಾಯಿಸುವುದಿಲ್ಲ:
ಎ) ಅಸಿಟಿಕ್ ಆಮ್ಲ; ಬಿ) ಬೆಳ್ಳಿ ಕ್ಲೋರೈಡ್;
ಸಿ) ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ; ಡಿ) ಪೊಟ್ಯಾಸಿಯಮ್ ಕ್ಲೋರೈಡ್
10. ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅನ್ನು ದೀರ್ಘಕಾಲದವರೆಗೆ ರವಾನಿಸುವ ಸುಣ್ಣದ ನೀರಿನ ದ್ರಾವಣದಲ್ಲಿ ವಿದ್ಯುದ್ವಾರಗಳನ್ನು ಮುಳುಗಿಸಿದರೆ, ಸಮಯಕ್ಕೆ ವಿರುದ್ಧವಾಗಿ ಸರ್ಕ್ಯೂಟ್ಗೆ ಸಂಪರ್ಕಗೊಂಡಿರುವ ವಿದ್ಯುತ್ ಬಲ್ಬ್ನ ತೀವ್ರತೆಯ ಗ್ರಾಫ್ ಹೇಗಿರುತ್ತದೆ?
ಎ) ರೇಖೀಯ ಹೆಚ್ಚಳ;
ಬಿ) ರೇಖೀಯ ಇಳಿಕೆ;
ಸಿ) ಮೊದಲು ಕಡಿಮೆಯಾಗುವುದು, ನಂತರ ಹೆಚ್ಚಾಗುತ್ತದೆ;
ಡಿ) ಮೊದಲು ಹೆಚ್ಚಾಗುತ್ತದೆ, ನಂತರ ಕಡಿಮೆಯಾಗುತ್ತದೆ.
ಸೂಚಕಗಳು- ಆಮ್ಲೀಯತೆ (pH) ಬದಲಾದಾಗ ದ್ರಾವಣದಲ್ಲಿ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸಬಹುದಾದ ಸಾವಯವ ಸಂಯುಕ್ತಗಳು. ವಿಶ್ಲೇಷಣಾತ್ಮಕ ರಸಾಯನಶಾಸ್ತ್ರ ಮತ್ತು ಜೀವರಸಾಯನಶಾಸ್ತ್ರದಲ್ಲಿನ ಟೈಟರೇಶನ್ಗಳಲ್ಲಿ ಸೂಚಕಗಳನ್ನು ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಅವರ ಅನುಕೂಲವೆಂದರೆ ಕಡಿಮೆ ವೆಚ್ಚ, ವೇಗ ಮತ್ತು ಸಂಶೋಧನೆಯ ಸ್ಪಷ್ಟತೆ.
ಪರೀಕ್ಷಿಸುತ್ತಿರುವ ದ್ರಾವಣದ ಮಾದರಿಗೆ ಜಲೀಯ ಅಥವಾ ಆಲ್ಕೊಹಾಲ್ಯುಕ್ತ ದ್ರಾವಣದ ಕೆಲವು ಹನಿಗಳನ್ನು ಅಥವಾ ಸ್ವಲ್ಪ ಪುಡಿಯನ್ನು ಸೇರಿಸುವ ಮೂಲಕ ಸೂಚಕಗಳನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಆದ್ದರಿಂದ, ಟೈಟರೇಶನ್ ಸಮಯದಲ್ಲಿ, ಪರೀಕ್ಷಾ ಪರಿಹಾರದ ಆಲ್ಕೋಟ್ಗೆ ಸೂಚಕವನ್ನು ಸೇರಿಸಲಾಗುತ್ತದೆ ಮತ್ತು ಸಮಾನತೆಯ ಹಂತದಲ್ಲಿ ಬಣ್ಣ ಬದಲಾವಣೆಗಳನ್ನು ಗಮನಿಸಬಹುದು.
ಸೂಚಕ ಬಣ್ಣ ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರಗಳು
ಜಲೀಯ ದ್ರಾವಣಗಳಲ್ಲಿ ಸೂಚಕಗಳ ವಿವಿಧ ಬಣ್ಣದ ರೂಪಗಳ ಅಸ್ತಿತ್ವದ ಬಗ್ಗೆ ಅಂಕಿ ಅಂದಾಜು ಡೇಟಾವನ್ನು ತೋರಿಸುತ್ತದೆ.
ಹೆಚ್ಚಿನ ವಿವರವಾದ ಮಾಹಿತಿಗಾಗಿ (ಬಹು ಪರಿವರ್ತನೆಗಳು, ಸಂಖ್ಯಾತ್ಮಕ pH ಮೌಲ್ಯ), ಮುಂದಿನ ವಿಭಾಗವನ್ನು ನೋಡಿ.
ಸಾಮಾನ್ಯ ಸೂಚಕಗಳಿಗಾಗಿ pH ಪರಿವರ್ತನೆ ಮೌಲ್ಯಗಳ ಕೋಷ್ಟಕ
ಪ್ರಯೋಗಾಲಯ ಅಭ್ಯಾಸದಲ್ಲಿ ಸಾಮಾನ್ಯವಾದ ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕಗಳನ್ನು ಬಣ್ಣ ಬದಲಾವಣೆಗಳಿಗೆ ಕಾರಣವಾಗುವ pH ಮೌಲ್ಯಗಳನ್ನು ಹೆಚ್ಚಿಸುವ ಸಲುವಾಗಿ ನೀಡಲಾಗುತ್ತದೆ. ಚದರ ಆವರಣದಲ್ಲಿರುವ ರೋಮನ್ ಅಂಕಿಗಳು ಬಣ್ಣ ಪರಿವರ್ತನೆ ಸಂಖ್ಯೆಗೆ ಅನುಗುಣವಾಗಿರುತ್ತವೆ (ಹಲವಾರು ಪರಿವರ್ತನೆಯ ಬಿಂದುಗಳೊಂದಿಗೆ ಸೂಚಕಗಳಿಗೆ).
| ಸೂಚಕ ಮತ್ತು ಪರಿವರ್ತನೆ ಸಂಖ್ಯೆ | X | ಹೆಚ್ಚು ಬಣ್ಣ ಮಾಡಿ ಆಮ್ಲೀಯ ರೂಪ | pH ಮಧ್ಯಂತರ ಮತ್ತು ಪರಿವರ್ತನೆ ಸಂಖ್ಯೆ | ಹೆಚ್ಚು ಬಣ್ಣ ಮಾಡಿ ಕ್ಷಾರೀಯ ರೂಪ |
||
|---|---|---|---|---|---|---|
| ಮೀಥೈಲ್ ನೇರಳೆ | ಹಳದಿ | 0.13-0.5 [I] | ಹಸಿರು | |||
| ಕ್ರೆಸೋಲ್ ಕೆಂಪು [I] | ಕೆಂಪು | 0.2-1.8 [I] | ಹಳದಿ | |||
| ಮೀಥೈಲ್ ನೇರಳೆ | ಹಸಿರು | 1,0-1,5 | ನೀಲಿ | |||
| ಥೈಮೋಲ್ ನೀಲಿ [I] | ಗೆ | ಕೆಂಪು | 1.2-2.8 [I] | ಹಳದಿ | ||
| ಟ್ರೋಪಿಯೋಲಿನ್ 00 | o | ಕೆಂಪು | 1,3-3,2 | ಹಳದಿ | ||
| ಮೀಥೈಲ್ ನೇರಳೆ | ನೀಲಿ | 2,0-3,0 | ನೇರಳೆ | |||
| (ಡೈ) ಮೀಥೈಲ್ ಹಳದಿ | o | ಕೆಂಪು | 3,0-4,0 | ಹಳದಿ | ||
| ಬ್ರೋಮೊಫೆನಾಲ್ ನೀಲಿ | ಗೆ | ಹಳದಿ | 3,0-4,6 | ನೀಲಿ-ನೇರಳೆ | ||
| ಕಾಂಗೋ ಕೆಂಪು | ಕೆಂಪು | 3,0-5,2 | ನೀಲಿ | |||
| ಮೀಥೈಲ್ ಕಿತ್ತಳೆ | o | ಕೆಂಪು | 3,1-(4,0)4,4 | (ಕಿತ್ತಳೆ-)ಹಳದಿ | ||
| ಬ್ರೋಮೊಕ್ರೆಸೋಲ್ ಹಸಿರು | ಗೆ | ಹಳದಿ | 3,8-5,4 | ನೀಲಿ | ||
| ಬ್ರೋಮೊಕ್ರೆಸಾಲ್ ನೀಲಿ | ಹಳದಿ | 3,8-5,4 | ನೀಲಿ | |||
| ಲ್ಯಾಕ್ಮೋಯ್ಡ್ | ಗೆ | ಕೆಂಪು | 4,0-6,4 | ನೀಲಿ | ||
| ಮೀಥೈಲ್ ಕೆಂಪು | o | ಕೆಂಪು | 4,2(4,4)-6,2(6,3) | ಹಳದಿ | ||
| ಕ್ಲೋರೊಫೆನಾಲ್ಗಳು ಕೆಂಪು | ಗೆ | ಹಳದಿ | 5,0-6,6 | ಕೆಂಪು | ||
| ಲಿಟ್ಮಸ್ (ಅಜೋಲಿಥ್ಮಿನ್) | ಕೆಂಪು | 5,0-8,0 (4,5-8,3) | ನೀಲಿ | |||
| ಬ್ರೋಮೊಕ್ರೆಸಾಲ್ ನೇರಳೆ | ಗೆ | ಹಳದಿ | 5,2-6,8(6,7) | ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು | ||
| ಬ್ರೋಮೋತಿಮಾಲ್ ನೀಲಿ | ಗೆ | ಹಳದಿ | 6,0-7,6 | ನೀಲಿ | ||
| ತಟಸ್ಥ ಕೆಂಪು | o | ಕೆಂಪು | 6,8-8,0 | ಅಂಬರ್ ಹಳದಿ | ||
| ಫೀನಾಲ್ ಕೆಂಪು | ಓ | ಹಳದಿ | 6,8-(8,0)8,4 | ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು | ||
| ಕ್ರೆಸೋಲ್ ಕೆಂಪು | ಗೆ | ಹಳದಿ | 7,0(7,2)-8,8 | ಗಾಢ ಕೆಂಪು | ||
| α-ನಾಫ್ಥಾಲ್ಫ್ಥಲೀನ್ | ಗೆ | ಹಳದಿ-ಗುಲಾಬಿ | 7,3-8,7 | ನೀಲಿ | ||
| ಥೈಮಾಲ್ ನೀಲಿ | ಗೆ | ಹಳದಿ | 8,0-9,6 | ನೀಲಿ | ||
| ಫಿನಾಲ್ಫ್ಥಲೀನ್ [I] | ಗೆ | ಬಣ್ಣರಹಿತ | 8.2-10.0 [I] | ರಾಸ್ಪ್ಬೆರಿ ಕೆಂಪು | ||
| ಥೈಮೋಲ್ಫ್ಥಲೀನ್ | ಗೆ | ಬಣ್ಣರಹಿತ | 9,3(9,4)-10,5(10,6) | ನೀಲಿ | ||
| ಅಲಿಜರಿನ್ ಹಳದಿ LJ | ಗೆ | ತಿಳಿ ನಿಂಬೆ ಹಳದಿ | 10,1-12,0 | ಕಂದು-ಹಳದಿ | ||
| ನೈಲ್ ನೀಲಿ | ನೀಲಿ | 10,1-11,1 | ಕೆಂಪು | |||
| ಡಯಾಜೊ ನೇರಳೆ | ಹಳದಿ | 10,1-12,0 | ನೇರಳೆ | |||
| ಇಂಡಿಗೊ ಕಾರ್ಮೈನ್ | ನೀಲಿ | 11,6-14,0 | ಹಳದಿ | |||
| ಎಪ್ಸಿಲಾನ್ ನೀಲಿ | ಕಿತ್ತಳೆ | 11,6-13,0 | ಗಾಢ ನೇರಳೆ | |||
ಶಾಲಾ ಪ್ರಯೋಗಾಲಯದಲ್ಲಿ ಸಸ್ಯ ಸೂಚಕಗಳು
ಪಾವ್ಲೋವಾ ಸರ್ಗಿಲಾನಾ
ಮಕರೋವಾ ವಿಕ್ಟೋರಿಯಾ
ವರ್ಗ 9 "B", MBOU "Vilyui ಸೆಕೆಂಡರಿ ಸ್ಕೂಲ್ ನಂ. 1 ಗೆ G.I ಹೆಸರಿಡಲಾಗಿದೆ. ಚಿರಿಯಾವ್" ವಿಲ್ಯುಸ್ಕ್ ರಿಪಬ್ಲಿಕ್ ಆಫ್ ಸಖಾ (ಯಾಕುಟಿಯಾ)
ಪೆಟ್ರೋವಾ ಅನ್ನಾ ಪ್ರೊಕೊಪಿಯೆವ್ನಾ
ವೈಜ್ಞಾನಿಕ ಮೇಲ್ವಿಚಾರಕ, ಶಿಕ್ಷಕ ಅತ್ಯುನ್ನತ ವರ್ಗ, ವಿಲ್ಯುಯಿ ಸೆಕೆಂಡರಿ ಸ್ಕೂಲ್ ನಂ. 1 ರ ರಸಾಯನಶಾಸ್ತ್ರ ಶಿಕ್ಷಕ ಜಿ.ಐ. ಚಿರಿಯಾವಾ", ವಿಲ್ಯುಸ್ಕ್
ಸೂಚಕಗಳು ರಾಸಾಯನಿಕ ಪದಾರ್ಥಗಳಾಗಿವೆ, ಅದರ ಬಣ್ಣವು ಪರಿಸರದ pH ಅನ್ನು ಅವಲಂಬಿಸಿ ಬದಲಾಗುತ್ತದೆ. ಲ್ಯಾಟಿನ್ ಭಾಷೆಯಲ್ಲಿ ಸೂಚಕ ಎಂದರೆ "ಪಾಯಿಂಟರ್".
ರಸಾಯನಶಾಸ್ತ್ರದ ಪಾಠಗಳಲ್ಲಿ ನಾವು ಲಿಟ್ಮಸ್, ಫೀನಾಲ್ಫ್ಥಲೀನ್, ಮೀಥೈಲ್ ಕಿತ್ತಳೆ ಮುಂತಾದ ಸೂಚಕಗಳನ್ನು ಬಳಸುತ್ತೇವೆ, ಇದು ಪರಿಹಾರದ ಪರಿಸರವನ್ನು ಅವಲಂಬಿಸಿ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತದೆ. ಗಾಢ ಬಣ್ಣದ ಹಣ್ಣುಗಳು, ಹಣ್ಣುಗಳು ಮತ್ತು ಹೂವುಗಳ ರಸಗಳು ಮತ್ತು ಡಿಕೊಕ್ಷನ್ಗಳು ಸಹ ಆಮ್ಲ-ಬೇಸ್ ಸೂಚಕಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಹೊಂದಿವೆ, ಅಂದರೆ, ಪರಿಸರದ ಆಮ್ಲೀಯತೆಯು ಬದಲಾದಾಗ ಅವು ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತವೆ.
ಪ್ರಸ್ತುತತೆ: ಪರಿಸರದ ಪ್ರತಿಕ್ರಿಯೆಯನ್ನು ನಿರ್ಧರಿಸಲು ಯಾಕುಟಿಯಾದಲ್ಲಿ ಬೆಳೆಯುವ ಸಸ್ಯಗಳ ಹಣ್ಣುಗಳಿಂದ ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕಗಳ ಬಳಕೆ.
ಕೆಲಸದ ಉದ್ದೇಶ : ನೈಸರ್ಗಿಕ ಕಚ್ಚಾ ವಸ್ತುಗಳಿಂದ ಸಸ್ಯ ಸೂಚಕಗಳನ್ನು ಪಡೆಯುವುದು.
ಕಾರ್ಯಗಳು:
· ಸಾಹಿತ್ಯವನ್ನು ಅಧ್ಯಯನ ಮಾಡಿ, ನಮ್ಮ ಪ್ರದೇಶದಲ್ಲಿ ಬೆಳೆಯುವ ಸಸ್ಯಗಳ ಹಣ್ಣುಗಳಿಂದ ಮನೆಯಲ್ಲಿ ಸೂಚಕಗಳನ್ನು ತಯಾರಿಸುವ ವಿಧಾನಗಳೊಂದಿಗೆ ಪರಿಚಿತರಾಗಿರಿ;
· ಪ್ರಾಯೋಗಿಕವಾಗಿ ಸೂಚಕಗಳ ಗುಂಪನ್ನು ಪಡೆದುಕೊಳ್ಳಿ.
ವಿವಿಧ ಪರಿಸರದಲ್ಲಿ ಸಸ್ಯ ಸೂಚಕಗಳ ನಡವಳಿಕೆಯನ್ನು ಅಧ್ಯಯನ ಮಾಡಿ.
· ಕೂದಲು ಆರೈಕೆಗಾಗಿ ಮಾರ್ಜಕಗಳ ಪರಿಹಾರಗಳ ಪರಿಸರವನ್ನು ನಿರ್ಧರಿಸಲು ಅಧ್ಯಯನವನ್ನು ನಡೆಸುವುದು.
ಅಧ್ಯಯನದ ವಸ್ತು: ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕ ಗುಣಲಕ್ಷಣಗಳೊಂದಿಗೆ ನೈಸರ್ಗಿಕ ಸಸ್ಯಗಳು.
ಕಲ್ಪನೆ: ಸಸ್ಯ ಸೂಚಕಗಳ ಪರಿಹಾರಗಳನ್ನು ಸ್ವತಂತ್ರವಾಗಿ ತಯಾರಿಸಬಹುದು ಮತ್ತು ಬಳಸಬಹುದು ಶಾಲೆಯ ಪ್ರಯೋಗಾಲಯ.
ಕೆಲಸದ ವಿಧಾನಗಳು ಮತ್ತು ತಂತ್ರಗಳು:
· ಪ್ರಾಯೋಗಿಕ ವಿಧಾನದೊಂದಿಗೆ ಪರಿಚಿತರಾಗಿ;
· ನೈಸರ್ಗಿಕ ಕಚ್ಚಾ ವಸ್ತುಗಳಿಂದ ಸೂಚಕಗಳ ಪರಿಹಾರಗಳನ್ನು ತಯಾರಿಸಿ;
· ಪರಿಸರವನ್ನು ಅವಲಂಬಿಸಿ ನೈಸರ್ಗಿಕ ಸೂಚಕಗಳ ಬಣ್ಣದಲ್ಲಿ ಬದಲಾವಣೆಗಳನ್ನು ಅಧ್ಯಯನ ಮಾಡಿ;
· ರಾಸಾಯನಿಕ ಪ್ರಯೋಗಗಳ ಸಮಯದಲ್ಲಿ ಸುರಕ್ಷತಾ ನಿಯಮಗಳನ್ನು ಅನುಸರಿಸಿ.
2. ಪ್ರಾಯೋಗಿಕ ಭಾಗ
2.1. ಕೃತಕ ಸೂಚಕಗಳೊಂದಿಗೆ ಪರಿಹಾರ ಪರಿಸರದ ನಿರ್ಣಯ
ಗುರಿ: ಎನ್ ಕೃತಕವಾಗಿ ಸಂಶ್ಲೇಷಿತ ಸೂಚಕಗಳೊಂದಿಗೆ ಆಮ್ಲಗಳು, ಕ್ಷಾರಗಳು ಮತ್ತು ಉಪ್ಪು ದ್ರಾವಣಗಳ ದ್ರಾವಣಗಳ ಬಣ್ಣದಲ್ಲಿನ ಬದಲಾವಣೆಯನ್ನು ಗಮನಿಸಿ.
ಕಾರಕಗಳು: ಹೈಡ್ರೋಕ್ಲೋರಿಕ್ ಆಮ್ಲ ಪರಿಹಾರ HCl, ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಪರಿಹಾರ KOH, ಪೊಟ್ಯಾಸಿಯಮ್ ಕಾರ್ಬೋನೇಟ್ ಪರಿಹಾರ K2CO3, ಸೋಡಿಯಂ ಕ್ಲೋರೈಡ್ ಪರಿಹಾರ NaCl, ಅಲ್ಯೂಮಿನಿಯಂ ಕ್ಲೋರೈಡ್ ಪರಿಹಾರ AlCl3.
ಕೆಳಗಿನ ಕೃತಕ ಸೂಚಕಗಳು ಶಾಲೆಯ ರಸಾಯನಶಾಸ್ತ್ರ ಪ್ರಯೋಗಾಲಯದಲ್ಲಿ ಲಭ್ಯವಿದೆ: ಫಿನಾಲ್ಫ್ಥಲೀನ್, ಮೀಥೈಲ್ ಕಿತ್ತಳೆ ಮತ್ತು ಲಿಟ್ಮಸ್. ತಟಸ್ಥ, ಆಮ್ಲೀಯ ಮತ್ತು ಕ್ಷಾರೀಯ ಪರಿಸರದಲ್ಲಿ ಬಣ್ಣ ಬದಲಾವಣೆಗಳಿಗಾಗಿ ನಾವು ಅವುಗಳನ್ನು ಪರಿಶೀಲಿಸಿದ್ದೇವೆ.
ಕೋಷ್ಟಕ 1.
ಪರಿಹಾರಗಳಲ್ಲಿ ಸೂಚಕಗಳ ಬಣ್ಣದಲ್ಲಿ ಬದಲಾವಣೆ
|
ಸೂಚಕ |
||||||
|
ಫೀನಾಲ್ಫ್ಥಲೀನ್ |
ಬಣ್ಣರಹಿತ |
ರಾಸ್ಪ್ಬೆರಿ |
ರಾಸ್ಪ್ಬೆರಿ |
ಬಣ್ಣರಹಿತ |
ಬಣ್ಣರಹಿತ |
|
|
ನೇರಳೆ |
||||||
|
ಮೀಥೈಲ್ ಕಿತ್ತಳೆ |
ಕಿತ್ತಳೆ |
ಟೇಬಲ್ 1 ರಿಂದ ಎಲ್ಲಾ ಸೂಚಕಗಳು ತಮ್ಮ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತವೆ ಎಂದು ನೋಡಬಹುದು: ಆಮ್ಲೀಯ ವಾತಾವರಣದಲ್ಲಿ ಕೆಂಪು ಬಣ್ಣಕ್ಕೆ (ಫೀನಾಲ್ಫ್ಥಲೀನ್ ಹೊರತುಪಡಿಸಿ); ತಟಸ್ಥವಾಗಿ ಅವು ತಮ್ಮ ನೈಸರ್ಗಿಕ ಬಣ್ಣವನ್ನು ಹೊಂದಿರುತ್ತವೆ, ಆದರೆ ಕ್ಷಾರೀಯದಲ್ಲಿ ಬಣ್ಣವು ಬಹಳವಾಗಿ ಬದಲಾಗುತ್ತದೆ. ಫಿನಾಲ್ಫ್ಥಲೀನ್ ದ್ರಾವಣದ ಬಣ್ಣವನ್ನು ಕಡುಗೆಂಪು ಬಣ್ಣಕ್ಕೆ, ಲಿಟ್ಮಸ್ ನೀಲಿ ಬಣ್ಣಕ್ಕೆ ಮತ್ತು ಮೀಥೈಲ್ ಕಿತ್ತಳೆ ಹಳದಿ ಬಣ್ಣಕ್ಕೆ ಬದಲಾಯಿಸುತ್ತದೆ.
2.2. ಸಸ್ಯ ಸೂಚಕಗಳನ್ನು ತಯಾರಿಸುವ ವಿಧಾನಗಳು
ಕಾಮಗಾರಿ ಪ್ರಗತಿ:
ಸಸ್ಯ ಸೂಚಕಗಳನ್ನು ತಯಾರಿಸಲು, 25 ಗ್ರಾಂ ಕಚ್ಚಾ ವಸ್ತುಗಳನ್ನು ತೆಗೆದುಕೊಳ್ಳಿ, ಅವುಗಳನ್ನು ಪುಡಿಮಾಡಿ, 100 ಮಿಲಿ ನೀರನ್ನು ಸೇರಿಸಿ ಮತ್ತು 1-2 ನಿಮಿಷಗಳ ಕಾಲ ಕುದಿಸಿ. ಪರಿಣಾಮವಾಗಿ ಡಿಕೊಕ್ಷನ್ಗಳನ್ನು ತಂಪಾಗಿಸಿ ಫಿಲ್ಟರ್ ಮಾಡಲಾಗುತ್ತದೆ. ಹಾಳಾಗುವುದನ್ನು ತಡೆಗಟ್ಟಲು, ಆಲ್ಕೋಹಾಲ್ ಅನ್ನು 2: 1 ಅನುಪಾತದಲ್ಲಿ ಪರಿಣಾಮವಾಗಿ ಶೋಧನೆಗೆ ಸೇರಿಸಲಾಗುತ್ತದೆ. ನಾವು ಲಿಂಗೊನ್ಬೆರಿಗಳು, ಕ್ರ್ಯಾನ್ಬೆರಿಗಳು, ರಾಸ್್ಬೆರ್ರಿಸ್, ಬೆರಿಹಣ್ಣುಗಳು, ಬೆರಿಹಣ್ಣುಗಳು, ಸ್ಟ್ರಾಬೆರಿಗಳು ಮತ್ತು ಬೀಟ್ ಹಣ್ಣುಗಳಿಂದ ಸೂಚಕಗಳನ್ನು ಸಿದ್ಧಪಡಿಸಿದ್ದೇವೆ.
2.3. ಸಸ್ಯ ಸೂಚಕಗಳನ್ನು ಬಳಸಿಕೊಂಡು ಪರಿಹಾರ ಪರಿಸರದ ನಿರ್ಣಯ.
ಸಂಶೋಧನಾ ಫಲಿತಾಂಶಗಳು:
ವಿಭಿನ್ನ ಪರಿಸರದಲ್ಲಿ ನೈಸರ್ಗಿಕ ಸೂಚಕಗಳ ಬಣ್ಣದಲ್ಲಿನ ಬದಲಾವಣೆಗಳನ್ನು ಅಧ್ಯಯನ ಮಾಡಲು, ಸಸ್ಯ ಸೂಚಕದ ಹಲವಾರು ಹನಿಗಳನ್ನು ಪೈಪೆಟ್ನೊಂದಿಗೆ ತೆಗೆದುಕೊಳ್ಳಲಾಗುತ್ತದೆ ಮತ್ತು ಪರ್ಯಾಯವಾಗಿ ಹೈಡ್ರೋಕ್ಲೋರಿಕ್ ಆಮ್ಲ, ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್, ಸೋಡಿಯಂ ಕ್ಲೋರೈಡ್, ಪೊಟ್ಯಾಸಿಯಮ್ ಕಾರ್ಬೋನೇಟ್ ಮತ್ತು ಅಲ್ಯೂಮಿನಿಯಂ ಕ್ಲೋರೈಡ್ ದ್ರಾವಣಗಳಿಗೆ ಸೇರಿಸಲಾಗುತ್ತದೆ. ಎಲ್ಲಾ ಪ್ರಯೋಗಗಳ ಫಲಿತಾಂಶಗಳನ್ನು ಕೋಷ್ಟಕದಲ್ಲಿ ನೀಡಲಾಗಿದೆ.
ಕೋಷ್ಟಕ 2.
ವಿವಿಧ ಪರಿಸರದಲ್ಲಿ ನೈಸರ್ಗಿಕ ಸೂಚಕಗಳ ಬಣ್ಣದಲ್ಲಿನ ಬದಲಾವಣೆಗಳು
|
ನೈಸರ್ಗಿಕ ಇಂಡಿಕಾ ಬಣ್ಣ |
ತಟಸ್ಥ ಪರಿಸರದಲ್ಲಿ ಬಣ್ಣ |
ಕ್ಷಾರೀಯ ಮಾಧ್ಯಮದಲ್ಲಿ ಬಣ್ಣ ಮಾಡುವುದು (KOH ದ್ರಾವಣ) |
ಕ್ಷಾರೀಯ ಮಾಧ್ಯಮದಲ್ಲಿ ಬಣ್ಣ ಮಾಡುವುದು (K 2 CO 3 ದ್ರಾವಣ) |
ಆಮ್ಲೀಯ ವಾತಾವರಣದಲ್ಲಿ ಬಣ್ಣ |
ಆಮ್ಲೀಯ ವಾತಾವರಣದಲ್ಲಿ ಬಣ್ಣ |
||
|
ಲಿಂಗೊನ್ಬೆರಿ ಬೆರ್ರಿ |
ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು |
ಬದಲಾಗುವುದಿಲ್ಲ |
ನೇರಳೆ |
||||
|
ರಾಸ್ಪ್ಬೆರಿ |
ಕೆಂಪು-ರಾಸ್ಪ್ಬೆರಿ |
ನೇರಳೆ |
|||||
|
ಕ್ರ್ಯಾನ್ಬೆರಿ |
|||||||
|
ಬ್ಲೂಬೆರ್ರಿ |
ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು |
ನೇರಳೆ |
|||||
|
ಸ್ಟ್ರಾಬೆರಿ |
ಕಿತ್ತಳೆ |
ಕಿತ್ತಳೆ |
ಕಿತ್ತಳೆ |
ಕಿತ್ತಳೆ |
|||
|
ಬ್ಲೂಬೆರ್ರಿ |
ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು |
ನೇರಳೆ |
|||||
|
ಬೀಟ್ ಹಣ್ಣುಗಳು |
ಬದಲಾಗುವುದಿಲ್ಲ |
ನಾವು ಆಯ್ಕೆ ಮಾಡಿದ ಎಲ್ಲಾ ವಸ್ತುಗಳು ಪರಿಸರದ ಆಮ್ಲೀಯತೆಯನ್ನು ಅವಲಂಬಿಸಿ ಅವುಗಳ ನೈಸರ್ಗಿಕ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತವೆ ಎಂದು ಕೋಷ್ಟಕ 2 ರಿಂದ ನೋಡಬಹುದಾಗಿದೆ. ಲಿಂಗೊನ್ಬೆರ್ರಿಸ್, ರಾಸ್್ಬೆರ್ರಿಸ್, ಬೆರಿಹಣ್ಣುಗಳು, ಕ್ರಾನ್ಬೆರಿಗಳು, ಸ್ಟ್ರಾಬೆರಿಗಳು, ಬೀಟ್ಗೆಡ್ಡೆಗಳು, ಹಣ್ಣುಗಳ ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು ಕಷಾಯ ಮತ್ತು ಹಣ್ಣುಗಳು ಆಮ್ಲೀಯ ವಾತಾವರಣದಲ್ಲಿ ಗುಲಾಬಿ-ಕೆಂಪು-ನೇರಳೆ ಮತ್ತು ಕ್ಷಾರೀಯ ವಾತಾವರಣದಲ್ಲಿ - ಹಳದಿ-ತಿಳಿ ಹಸಿರು ಬಣ್ಣದಲ್ಲಿ ಇದನ್ನು ಚೆನ್ನಾಗಿ ಗಮನಿಸಬಹುದು.
ತೀರ್ಮಾನ: ಸಸ್ಯದ ಹಣ್ಣುಗಳು ಆಮ್ಲೀಯ ವಾತಾವರಣವನ್ನು ಹೊಂದಿರುತ್ತವೆ, ಆದ್ದರಿಂದ ಆಮ್ಲೀಯ ವಾತಾವರಣದಲ್ಲಿ ದ್ರಾವಣದ ಬಣ್ಣವು ಬದಲಾಗುವುದಿಲ್ಲ, ಬಣ್ಣವು ಕೆಂಪು ಬಣ್ಣದ್ದಾಗಿರುತ್ತದೆ. ಕ್ಷಾರೀಯ ವಾತಾವರಣದಲ್ಲಿ, ದ್ರಾವಣಗಳು ಹಳದಿ ಬಣ್ಣದಿಂದ ಹಸಿರು ಬಣ್ಣಕ್ಕೆ ತಿರುಗುತ್ತವೆ. ಸಸ್ಯಗಳ ಹಣ್ಣುಗಳಿಂದ, ಬೀಟ್ ಹಣ್ಣುಗಳು ಪರಿಹಾರಗಳ ಉಚ್ಚಾರಣಾ ಬಣ್ಣಗಳನ್ನು ಪಡೆಯುತ್ತವೆ;
2.4. ಸೂಚಕ ಪತ್ರಿಕೆಗಳ ತಯಾರಿಕೆ.
ಫಿಲ್ಟರ್ ಪೇಪರ್ ಮತ್ತು ಸಸ್ಯ ಸೂಚಕಗಳಿಂದ ಸಾರಗಳನ್ನು ಬಳಸಿ, ನಾವು ಸೂಚಕ ಪತ್ರಿಕೆಗಳನ್ನು ಸಿದ್ಧಪಡಿಸಿದ್ದೇವೆ. ತಯಾರಿಕೆಯ ವಿಧಾನವು ತುಂಬಾ ಸರಳವಾಗಿದೆ: ಸಸ್ಯ ಸೂಚಕದ ಸಾರದಿಂದ ಪರಿಹಾರವನ್ನು ಪೈಪೆಟ್ ಬಳಸಿ ಫಿಲ್ಟರ್ ಪೇಪರ್ಗೆ ಅನ್ವಯಿಸಲಾಗುತ್ತದೆ, ಒಣಗಿಸಿ ಮತ್ತು ಕಾರ್ಯವಿಧಾನವನ್ನು ಮತ್ತೆ ಪುನರಾವರ್ತಿಸಲಾಗುತ್ತದೆ.
ವಿವಿಧ ಪರಿಸರದಲ್ಲಿ ತುಂಬಿದ ಸೂಚಕ ಪೇಪರ್ಗಳ ಬಣ್ಣದಲ್ಲಿನ ಬದಲಾವಣೆಯು ಒಂದೇ ರೀತಿಯ ಸಸ್ಯ ಸೂಚಕದ ಸಾರದ ಬಣ್ಣದಲ್ಲಿನ ಬದಲಾವಣೆಗೆ ಅನುರೂಪವಾಗಿದೆ.
2.5. ಡಿಟರ್ಜೆಂಟ್ ಪರಿಹಾರಗಳ ಪರಿಸರದ ನಿರ್ಣಯ.
ಕಾರಕಗಳು: ಸಸ್ಯ ಸೂಚಕಗಳು, ಶಾಂಪೂ ಪರಿಹಾರಗಳು: ಸಂಪೂರ್ಣ, ವಿಶೇಷ ಸರಣಿ (ಬಿಯರ್), ತಲೆ ಮತ್ತು ಭುಜಗಳು, ಟಾರ್, ಕ್ಲಿಯರ್ ವೀಟಾ ಅಬೆ.
ಕಾಮಗಾರಿ ಪ್ರಗತಿ: ನಾವು ಅಧ್ಯಯನದ ಅಡಿಯಲ್ಲಿ ಪ್ರತಿ ಡಿಟರ್ಜೆಂಟ್ ಅನ್ನು ನೀರಿನಲ್ಲಿ ಕರಗಿಸಿ ಐದು ಭಾಗಗಳಾಗಿ ವಿಭಜಿಸುತ್ತೇವೆ. ನಾವು ಅವರಿಗೆ ನೈಸರ್ಗಿಕ ಸೂಚಕಗಳ ಡ್ರಾಪ್ ಅನ್ನು ಸೇರಿಸುತ್ತೇವೆ. ಅವುಗಳಲ್ಲಿ ಪ್ರತಿಯೊಂದರಲ್ಲೂ, ಸೂಚಕಗಳು ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸಿದವು. (ಕೋಷ್ಟಕ 3).
ಕೋಷ್ಟಕ 3.
ಡಿಟರ್ಜೆಂಟ್ ದ್ರಾವಣಗಳಲ್ಲಿ ನೈಸರ್ಗಿಕ ಸೂಚಕಗಳ ಬಣ್ಣದಲ್ಲಿ ಬದಲಾವಣೆ
|
ಸೂಚಕವನ್ನು ತಯಾರಿಸಲು ಕಚ್ಚಾ ವಸ್ತುಗಳು |
ನೈಸರ್ಗಿಕ ಇಂಡಿಕಾ ಬಣ್ಣ |
ತಲೆ ಮತ್ತು ಭುಜಗಳು |
ಡೆಗ್ತ್ಯರ್ನಾಯ |
ವಿಶೇಷ ಸರಣಿ (ಬಿಯರ್) |
|||
|
ಲಿಂಗೊನ್ಬೆರಿ ಬೆರ್ರಿ |
ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು |
||||||
|
ರಾಸ್ಪ್ಬೆರಿ |
ಕೆಂಪು- |
||||||
|
ಕ್ರ್ಯಾನ್ಬೆರಿ |
|||||||
|
ಬ್ಲೂಬೆರ್ರಿ |
ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು |
ತಿಳಿ ನೀಲಿ |
|||||
|
ಸ್ಟ್ರಾಬೆರಿ |
ಕಿತ್ತಳೆ |
||||||
|
ಬ್ಲೂಬೆರ್ರಿ |
ಪ್ರಕಾಶಮಾನವಾದ ಕೆಂಪು |
||||||
|
ಬೀಟ್ ಹಣ್ಣುಗಳು |
ಕಿತ್ತಳೆ |
ಕಿತ್ತಳೆ |
ಕಿತ್ತಳೆ |
ಅಧ್ಯಯನದಿಂದ ತೀರ್ಮಾನಗಳು:
1. ಎಲ್ಲಾ ಸೂಚಕಗಳು: ಮನೆಯಲ್ಲಿ ಮತ್ತು ಕಾರ್ಖಾನೆಯಲ್ಲಿ ತಯಾರಿಸಿದ ಸಾರ್ವತ್ರಿಕ ಕಾಗದ, ಎಲ್ಲಾ ಪರೀಕ್ಷಿತ ಮಾಧ್ಯಮಗಳಲ್ಲಿ ಪರಿಸರದ ಸೂಕ್ತ ಸ್ವರೂಪವನ್ನು ತೋರಿಸಿದೆ.
2. ಮಾನವ ಚರ್ಮವು ಸ್ವಲ್ಪ ಆಮ್ಲೀಯ ವಾತಾವರಣವನ್ನು ಹೊಂದಿದೆ. ಚರ್ಮ ಮತ್ತು ಕೂದಲನ್ನು ರಕ್ಷಿಸಲು ಋಣಾತ್ಮಕ ಪರಿಣಾಮ ಮಾರ್ಜಕಎಪಿಡರ್ಮಿಸ್ನ pH ಮೌಲ್ಯಕ್ಕೆ ಅನುಗುಣವಾದ ಮೌಲ್ಯವನ್ನು ಹೊಂದಿರಬೇಕು. ಕೂದಲಿನ ಶ್ಯಾಂಪೂಗಳು ಸ್ವಲ್ಪ ಆಮ್ಲೀಯ ವಾತಾವರಣವನ್ನು ಹೊಂದಿರುತ್ತವೆ, ಇದು ಈ ಉತ್ಪನ್ನಗಳಿಗೆ ನೈರ್ಮಲ್ಯದ ಅವಶ್ಯಕತೆಗಳನ್ನು ಪೂರೈಸುತ್ತದೆ. ವಿಭಿನ್ನ ತಯಾರಕರ ಶಾಂಪೂಗಳ ನಮ್ಮ ಅಧ್ಯಯನಗಳ ಪ್ರಕಾರ, ಶ್ಯಾಂಪೂಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಪ್ರಮಾಣಿತ ಸೂಚಕಗಳಿಗೆ ಅನುಗುಣವಾಗಿರುತ್ತವೆ, ಆದರೆ ಕ್ಲಿಯರ್ ವೀಟಾ ಅಬೆ ಶಾಂಪೂ ಇತರ ಶ್ಯಾಂಪೂಗಳಿಗಿಂತ ಹೆಚ್ಚು ಆಮ್ಲೀಯವಾಗಿದೆ. ಆಮ್ಲೀಯತೆಯ ವಿಷಯದಲ್ಲಿ ಎರಡನೇ ಸ್ಥಾನವನ್ನು ಅಬ್ಸೊಲಟ್ ಶಾಂಪೂ ಮತ್ತು ಮೂರನೇ ಸ್ಥಾನವನ್ನು ಡೆಗ್ಟಿಯರ್ನಾಯಾ ಶಾಂಪೂ ಆಕ್ರಮಿಸಿಕೊಂಡಿದೆ.
ತೀರ್ಮಾನ:
ಶಾಲೆಯ ಪ್ರಯೋಗಾಲಯದಲ್ಲಿ ಸಸ್ಯ ಸೂಚಕಗಳನ್ನು ಪಡೆಯುವ ವಿಧಾನವನ್ನು ಬಳಸಿಕೊಂಡು, ನಾವು ಈ ಕೆಳಗಿನ ತೀರ್ಮಾನಗಳಿಗೆ ಬಂದಿದ್ದೇವೆ:
1. ಲಿಟ್ಮಸ್, ಮೀಥೈಲ್ ಆರೆಂಜ್ ಮತ್ತು ಫೀನಾಲ್ಫ್ಥಲೀನ್ ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕಗಳು ಶಾಲೆಯಲ್ಲಿ ಹೆಚ್ಚಾಗಿ ಬಳಸಲ್ಪಡುತ್ತವೆ. ಅವುಗಳ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುವ ಮೂಲಕ, ಮಾಧ್ಯಮದ ಪ್ರತಿಕ್ರಿಯೆಯನ್ನು ಮಾತ್ರ ನಿರ್ಣಯಿಸಬಹುದು, ಆದರೆ ದ್ರಾವಣದ pH ಅನ್ನು ಸಾಕಷ್ಟು ನಿಖರವಾಗಿ ನಿರ್ಧರಿಸಬಹುದು.
2. ಸಸ್ಯ ಸೂಚಕಗಳು ಸಾಕಷ್ಟು ಹೊಂದಿವೆ ಹೆಚ್ಚಿನ ಸೂಕ್ಷ್ಮತೆ, ಆದ್ದರಿಂದ ಅವುಗಳನ್ನು ಚುನಾಯಿತ ಕೋರ್ಸ್ನಲ್ಲಿ ಶಾಲಾ ಪ್ರಯೋಗಾಲಯದಲ್ಲಿ, ರಸಾಯನಶಾಸ್ತ್ರ ಕ್ಲಬ್ಗಳಲ್ಲಿ ಪರಿಹಾರಗಳ ಪರಿಸರವನ್ನು ನಿರ್ಧರಿಸಲು ಮತ್ತು ಪ್ರದೇಶದ ಮಣ್ಣಿನ ಆಮ್ಲೀಯತೆಯನ್ನು ನಿರ್ಧರಿಸಲು ಆಮ್ಲ-ಬೇಸ್ ಸೂಚಕಗಳಾಗಿ ಬಳಸಬಹುದು.
ಅನುಬಂಧ ಸಂಖ್ಯೆ 1
ಚಿತ್ರ 1. ನೈಸರ್ಗಿಕ ಸೂಚಕಗಳ ಬಣ್ಣ ಬದಲಾವಣೆಯನ್ನು ಅಧ್ಯಯನ ಮಾಡಲು, ನಾವು ಪಿಪೆಟ್ನೊಂದಿಗೆ ಮನೆಯಲ್ಲಿ ತಯಾರಿಸಿದ ಸೂಚಕದ ಕೆಲವು ಹನಿಗಳನ್ನು ತೆಗೆದುಕೊಂಡು ಅವುಗಳನ್ನು ಸೋಡಿಯಂ ಕ್ಲೋರೈಡ್, ಪೊಟ್ಯಾಸಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡ್, ಪೊಟ್ಯಾಸಿಯಮ್ ಕಾರ್ಬೋನೇಟ್, ಹೈಡ್ರೋಕ್ಲೋರಿಕ್ ಆಮ್ಲ ಮತ್ತು ಅಲ್ಯೂಮಿನಿಯಂ ಕ್ಲೋರೈಡ್ ದ್ರಾವಣಗಳಿಗೆ ಪರ್ಯಾಯವಾಗಿ ಸೇರಿಸುತ್ತೇವೆ.

ಚಿತ್ರ 2. ಸಿದ್ಧಪಡಿಸಿದ ಸಸ್ಯ ಸೂಚಕಗಳ ಸೆಟ್

ಚಿತ್ರ 3. ನಡೆಸಿದ ಪ್ರಯೋಗಗಳ ಸಾಮಾನ್ಯ ನೋಟ

ಚಿತ್ರ 4. ಸಿದ್ಧ ಕಾಗದದ ಸೂಚಕಗಳು

ಚಿತ್ರ 5. ವಿವಿಧ ಪರಿಸರದಲ್ಲಿ ಕಾಗದದ ಸೂಚಕಗಳ ಬಣ್ಣದಲ್ಲಿ ಬದಲಾವಣೆ
ಉಲ್ಲೇಖಗಳು:
1. ದೊಡ್ಡ ವಿಶ್ವಕೋಶ ನಿಘಂಟು - 2 ನೇ ಆವೃತ್ತಿ., ಪರಿಷ್ಕರಿಸಲಾಗಿದೆ. ಮತ್ತು ಹೆಚ್ಚುವರಿ - ಎಂ.: "ಬಿಗ್ ರಷ್ಯನ್ ಎನ್ಸೈಕ್ಲೋಪೀಡಿಯಾ"; ಸೇಂಟ್ ಪೀಟರ್ಸ್ಬರ್ಗ್: "ನೊರಿಂಟ್", 2001.
2. ಓಲ್ಜಿನ್ ಒ., ಸ್ಫೋಟಗಳಿಲ್ಲದ ಪ್ರಯೋಗಗಳು./ ಒ. ಓಲ್ಗಿನ್. - ಎಂ.: ರಸಾಯನಶಾಸ್ತ್ರ, 1986.
3. ಸೆಮೆನೋವ್ ಪಿ.ಪಿ. "ಸ್ಥಳೀಯ ಸಸ್ಯ ವಸ್ತುಗಳಿಂದ ಸೂಚಕಗಳು", "ಶಾಲೆಯಲ್ಲಿ ರಸಾಯನಶಾಸ್ತ್ರ", 1984, ಸಂಖ್ಯೆ 1, ಪುಟ 73.
4. ಸ್ಟೆಪಿನ್ ಎಸ್.ಎಸ್., ಅಲಿಕ್ಬೆರೋವಾ ಎಲ್.ಯು. ರಸಾಯನಶಾಸ್ತ್ರದಲ್ಲಿ ಮನರಂಜನೆಯ ಕಾರ್ಯಗಳು ಮತ್ತು ಅದ್ಭುತ ಪ್ರಯೋಗಗಳು, M.: "ಡ್ರೋಫಾ", 2002.
ಸೂಚಕಗಳು(ಲ್ಯಾಟಿನ್ ಸೂಚಕದಿಂದ - ಪಾಯಿಂಟರ್) - ಮಾಧ್ಯಮದ ಸಂಯೋಜನೆ ಅಥವಾ ಹರಿವನ್ನು ಮೇಲ್ವಿಚಾರಣೆ ಮಾಡಲು ನಿಮಗೆ ಅನುಮತಿಸುವ ವಸ್ತುಗಳು ರಾಸಾಯನಿಕ ಕ್ರಿಯೆ. ಕೆಲವು ಸಾಮಾನ್ಯವಾದ ಆಮ್ಲ-ಬೇಸ್ ಸೂಚಕಗಳು, ದ್ರಾವಣದ ಆಮ್ಲೀಯತೆಯನ್ನು ಅವಲಂಬಿಸಿ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತವೆ. ಇದು ಸಂಭವಿಸುತ್ತದೆ ಏಕೆಂದರೆ ಆಮ್ಲೀಯ ಮತ್ತು ಕ್ಷಾರೀಯ ಪರಿಸರದಲ್ಲಿ, ಸೂಚಕ ಅಣುಗಳು ವಿಭಿನ್ನ ರಚನೆಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಒಂದು ಉದಾಹರಣೆಯೆಂದರೆ ಸಾಮಾನ್ಯ ಸೂಚಕ ಫೀನಾಲ್ಫ್ಥಲೀನ್, ಇದನ್ನು ಹಿಂದೆ ಪರ್ಜೆನ್ ಎಂಬ ಹೆಸರಿನಲ್ಲಿ ವಿರೇಚಕವಾಗಿಯೂ ಬಳಸಲಾಗುತ್ತಿತ್ತು. ಆಮ್ಲೀಯ ವಾತಾವರಣದಲ್ಲಿ, ಈ ಸಂಯುಕ್ತವು ಅಸಂಘಟಿತ ಅಣುಗಳ ರೂಪದಲ್ಲಿರುತ್ತದೆ, ಮತ್ತು ದ್ರಾವಣವು ಬಣ್ಣರಹಿತವಾಗಿರುತ್ತದೆ ಮತ್ತು ಕ್ಷಾರೀಯ ವಾತಾವರಣದಲ್ಲಿ, ಇದು ಏಕ ಚಾರ್ಜ್ಡ್ ಅಯಾನುಗಳ ರೂಪದಲ್ಲಿರುತ್ತದೆ ಮತ್ತು ದ್ರಾವಣವು ಕಡುಗೆಂಪು ಬಣ್ಣವನ್ನು ಹೊಂದಿರುತ್ತದೆ ( ಸೆಂ.ಮೀ. ಎಲೆಕ್ಟ್ರೋಲಿಟಿಕ್ ಡಿಸ್ಸೋಸಿಯೇಷನ್. ಎಲೆಕ್ಟ್ರೋಲೈಟ್ಸ್). ಆದಾಗ್ಯೂ, ಹೆಚ್ಚು ಕ್ಷಾರೀಯ ವಾತಾವರಣದಲ್ಲಿ, ಫಿನಾಲ್ಫ್ಥಲೀನ್ ಮತ್ತೆ ಬಣ್ಣಕ್ಕೆ ತಿರುಗುತ್ತದೆ! ಸೂಚಕದ ಮತ್ತೊಂದು ಬಣ್ಣರಹಿತ ರೂಪದ ರಚನೆಯಿಂದಾಗಿ ಇದು ಸಂಭವಿಸುತ್ತದೆ - ಟ್ರಿಪಲ್ ಚಾರ್ಜ್ಡ್ ಅಯಾನ್ ರೂಪದಲ್ಲಿ. ಅಂತಿಮವಾಗಿ, ಕೇಂದ್ರೀಕೃತ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದಲ್ಲಿ, ಕೆಂಪು ಬಣ್ಣವು ಮತ್ತೆ ಕಾಣಿಸಿಕೊಳ್ಳುತ್ತದೆ, ಆದರೂ ತೀವ್ರವಾಗಿಲ್ಲ. ಇದರ ಅಪರಾಧಿ ಫಿನಾಲ್ಫ್ಥಲೀನ್ ಕ್ಯಾಷನ್ ಆಗಿದೆ. ಈ ಸ್ವಲ್ಪ ತಿಳಿದಿರುವ ಸತ್ಯಪರಿಸರದ ಪ್ರತಿಕ್ರಿಯೆಯನ್ನು ನಿರ್ಧರಿಸುವಲ್ಲಿ ದೋಷಕ್ಕೆ ಕಾರಣವಾಗಬಹುದು.
ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕಗಳು ಬಹಳ ವೈವಿಧ್ಯಮಯವಾಗಿವೆ; ಅವುಗಳಲ್ಲಿ ಹಲವು ಸುಲಭವಾಗಿ ಪ್ರವೇಶಿಸಬಹುದು ಮತ್ತು ಆದ್ದರಿಂದ ಶತಮಾನಗಳಿಂದ ತಿಳಿದುಬಂದಿದೆ. ಇವು ಬಣ್ಣದ ಹೂವುಗಳು, ಹಣ್ಣುಗಳು ಮತ್ತು ಹಣ್ಣುಗಳ ಡಿಕೊಕ್ಷನ್ಗಳು ಅಥವಾ ಸಾರಗಳಾಗಿವೆ. ಹೀಗಾಗಿ, ಐರಿಸ್, ಪ್ಯಾನ್ಸಿಗಳು, ಟುಲಿಪ್ಸ್, ಬೆರಿಹಣ್ಣುಗಳು, ಬ್ಲ್ಯಾಕ್ಬೆರಿಗಳು, ರಾಸ್್ಬೆರ್ರಿಸ್, ಕಪ್ಪು ಕರಂಟ್್ಗಳು, ಕೆಂಪು ಎಲೆಕೋಸು, ಬೀಟ್ಗೆಡ್ಡೆಗಳು ಮತ್ತು ಇತರ ಸಸ್ಯಗಳ ಕಷಾಯವು ಆಮ್ಲೀಯ ವಾತಾವರಣದಲ್ಲಿ ಕೆಂಪು ಮತ್ತು ಕ್ಷಾರೀಯ ವಾತಾವರಣದಲ್ಲಿ ಹಸಿರು-ನೀಲಿ ಬಣ್ಣಕ್ಕೆ ತಿರುಗುತ್ತದೆ. ಸಾಬೂನು (ಅಂದರೆ ಕ್ಷಾರೀಯ) ನೀರಿನಿಂದ ಬೋರ್ಚ್ಟ್ನ ಅವಶೇಷಗಳೊಂದಿಗೆ ನೀವು ಪ್ಯಾನ್ ಅನ್ನು ತೊಳೆದರೆ ಇದನ್ನು ಗಮನಿಸುವುದು ಸುಲಭ. ಆಮ್ಲೀಯ ದ್ರಾವಣ (ವಿನೆಗರ್) ಮತ್ತು ಕ್ಷಾರೀಯ ದ್ರಾವಣವನ್ನು ಬಳಸಿ (ಅಡಿಗೆ ಸೋಡಾ, ಅಥವಾ ಇನ್ನೂ ಉತ್ತಮ, ತೊಳೆಯುವ ಸೋಡಾ), ನೀವು ಕೆಂಪು ಅಥವಾ ನೀಲಿ ಬಣ್ಣದಲ್ಲಿ ವಿವಿಧ ಬಣ್ಣಗಳ ದಳಗಳ ಮೇಲೆ ಶಾಸನಗಳನ್ನು ಮಾಡಬಹುದು.
ನಿಯಮಿತ ಚಹಾ ಸಹ ಸೂಚಕವಾಗಿದೆ. ನೀವು ನಿಂಬೆ ರಸವನ್ನು ಗಾಜಿನ ಬಲವಾದ ಚಹಾಕ್ಕೆ ಬಿಟ್ಟರೆ ಅಥವಾ ಕೆಲವು ಹರಳುಗಳನ್ನು ಕರಗಿಸಿ ಸಿಟ್ರಿಕ್ ಆಮ್ಲ, ನಂತರ ಚಹಾ ತಕ್ಷಣವೇ ಹಗುರವಾಗುತ್ತದೆ. ನೀವು ಚಹಾದಲ್ಲಿ ಅಡಿಗೆ ಸೋಡಾವನ್ನು ಕರಗಿಸಿದರೆ, ದ್ರಾವಣವು ಗಾಢವಾಗುತ್ತದೆ (ಸಹಜವಾಗಿ, ನೀವು ಅಂತಹ ಚಹಾವನ್ನು ಕುಡಿಯಬಾರದು). ಹೂವುಗಳಿಂದ ಮಾಡಿದ ಚಹಾ ("ದಾಸವಾಳ") ಹೆಚ್ಚು ಗಾಢವಾದ ಬಣ್ಣಗಳನ್ನು ಉತ್ಪಾದಿಸುತ್ತದೆ.
ಬಹುಶಃ ಅತ್ಯಂತ ಹಳೆಯ ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕ ಲಿಟ್ಮಸ್ ಆಗಿದೆ. 1640 ರಲ್ಲಿ, ಸಸ್ಯಶಾಸ್ತ್ರಜ್ಞರು ಹೆಲಿಯೋಟ್ರೋಪ್ (ಹೆಲಿಯೊಟ್ರೋಪಿಯಮ್ ಟರ್ನ್ಸೋಲ್) ಅನ್ನು ವಿವರಿಸಿದರು, ಇದು ಗಾಢ ನೇರಳೆ ಹೂವುಗಳನ್ನು ಹೊಂದಿರುವ ಪರಿಮಳಯುಕ್ತ ಸಸ್ಯವಾಗಿದೆ, ಇದರಿಂದ ಬಣ್ಣ ಪದಾರ್ಥವನ್ನು ಪ್ರತ್ಯೇಕಿಸಲಾಗಿದೆ. ನೇರಳೆ ರಸದೊಂದಿಗೆ ಈ ವರ್ಣವನ್ನು ರಸಾಯನಶಾಸ್ತ್ರಜ್ಞರು ಸೂಚಕವಾಗಿ ವ್ಯಾಪಕವಾಗಿ ಬಳಸಿದರು, ಇದು ಆಮ್ಲೀಯ ವಾತಾವರಣದಲ್ಲಿ ಕೆಂಪು ಮತ್ತು ಕ್ಷಾರೀಯ ವಾತಾವರಣದಲ್ಲಿ ನೀಲಿ ಬಣ್ಣದ್ದಾಗಿತ್ತು. 17 ನೇ ಶತಮಾನದ ಪ್ರಸಿದ್ಧ ಭೌತಶಾಸ್ತ್ರಜ್ಞ ಮತ್ತು ರಸಾಯನಶಾಸ್ತ್ರಜ್ಞ ರಾಬರ್ಟ್ ಬೋಯ್ಲ್ ಅವರ ಕೃತಿಗಳಲ್ಲಿ ನೀವು ಇದರ ಬಗ್ಗೆ ಓದಬಹುದು. ಮೊದಲಿಗೆ, ಹೊಸ ಸೂಚಕವನ್ನು ಬಳಸಿ, ನಾವು ಅಧ್ಯಯನ ಮಾಡಿದ್ದೇವೆ ಖನಿಜಯುಕ್ತ ನೀರು, ಮತ್ತು ಸುಮಾರು 1670 ರಿಂದ ಅವರು ಅದನ್ನು ರಾಸಾಯನಿಕ ಪ್ರಯೋಗಗಳಲ್ಲಿ ಬಳಸಲು ಪ್ರಾರಂಭಿಸಿದರು. "ನಾನು ಅತ್ಯಲ್ಪ ಪ್ರಮಾಣದ ಆಮ್ಲವನ್ನು ಸೇರಿಸಿದ ತಕ್ಷಣ," ಫ್ರೆಂಚ್ ರಸಾಯನಶಾಸ್ತ್ರಜ್ಞ ಪಿಯರೆ ಪೌಮ್ 1694 ರಲ್ಲಿ "ಟೂರ್ನೆಸೊಲ್" ಬಗ್ಗೆ ಬರೆದರು, "ಅದು ಕೆಂಪು ಬಣ್ಣಕ್ಕೆ ತಿರುಗುತ್ತದೆ, ಆದ್ದರಿಂದ ಯಾರಾದರೂ ಆಮ್ಲವನ್ನು ಹೊಂದಿದೆಯೇ ಎಂದು ತಿಳಿದುಕೊಳ್ಳಲು ಬಯಸಿದರೆ, ಅದನ್ನು ಬಳಸಬಹುದು." 1704, ಜರ್ಮನ್ ವಿಜ್ಞಾನಿ ಎಂ. ವ್ಯಾಲೆಂಟಿನ್ ಈ ಬಣ್ಣವನ್ನು ಲಿಟ್ಮಸ್ ಎಂದು ಕರೆದರು, ಫ್ರೆಂಚ್ ಭಾಷೆಯಲ್ಲಿ ಲಿಟ್ಮಸ್ ಅನ್ನು ಟೂರ್ನೆಸೋಲ್ ಎಂದು ಕರೆಯುತ್ತಾರೆ, ಇದರ ಅರ್ಥ "ಸೂರ್ಯಕಾಂತಿ" ಎಂದು ಕರೆಯುತ್ತಾರೆ , "ಹೆಲಿಯೋಟ್ರೋಪ್", ಗ್ರೀಕ್ನಲ್ಲಿ ಮಾತ್ರ ಲಿಟ್ಮಸ್ ಅನ್ನು ಅಗ್ಗದ ಕಚ್ಚಾ ವಸ್ತುಗಳಿಂದ ಪಡೆಯಬಹುದು, ಉದಾಹರಣೆಗೆ, ಕೆಲವು ವಿಧದ ಕಲ್ಲುಹೂವುಗಳಿಂದ.
ದುರದೃಷ್ಟವಶಾತ್, ಬಹುತೇಕ ಎಲ್ಲಾ ನೈಸರ್ಗಿಕ ಸೂಚಕಗಳು ಗಂಭೀರ ನ್ಯೂನತೆಯನ್ನು ಹೊಂದಿವೆ: ಅವುಗಳ ಡಿಕೊಕ್ಷನ್ಗಳು ಸಾಕಷ್ಟು ಬೇಗನೆ ಹದಗೆಡುತ್ತವೆ - ಅವು ಹುಳಿ ಅಥವಾ ಅಚ್ಚುಗೆ ತಿರುಗುತ್ತವೆ (ಆಲ್ಕೋಹಾಲ್ ದ್ರಾವಣಗಳು ಹೆಚ್ಚು ಸ್ಥಿರವಾಗಿರುತ್ತವೆ). ಮತ್ತೊಂದು ನ್ಯೂನತೆಯೆಂದರೆ ಬಣ್ಣ ಬದಲಾವಣೆಯ ಮಧ್ಯಂತರವು ತುಂಬಾ ವಿಶಾಲವಾಗಿದೆ. ಈ ಸಂದರ್ಭದಲ್ಲಿ, ಪ್ರತ್ಯೇಕಿಸಲು ಕಷ್ಟ ಅಥವಾ ಅಸಾಧ್ಯ, ಉದಾಹರಣೆಗೆ, ದುರ್ಬಲವಾದ ಆಮ್ಲೀಯದಿಂದ ತಟಸ್ಥ ಮಾಧ್ಯಮ ಅಥವಾ ಬಲವಾಗಿ ಕ್ಷಾರೀಯದಿಂದ ದುರ್ಬಲ ಕ್ಷಾರೀಯ. ಆದ್ದರಿಂದ, ರಾಸಾಯನಿಕ ಪ್ರಯೋಗಾಲಯಗಳು ಸಂಶ್ಲೇಷಿತ ಸೂಚಕಗಳನ್ನು ಬಳಸುತ್ತವೆ, ಅದು ಸಾಕಷ್ಟು ಕಿರಿದಾದ pH ಮಿತಿಗಳಲ್ಲಿ ತಮ್ಮ ಬಣ್ಣವನ್ನು ತೀವ್ರವಾಗಿ ಬದಲಾಯಿಸುತ್ತದೆ. ಅಂತಹ ಅನೇಕ ಸೂಚಕಗಳು ತಿಳಿದಿವೆ, ಮತ್ತು ಅವುಗಳಲ್ಲಿ ಪ್ರತಿಯೊಂದೂ ತನ್ನದೇ ಆದ ಅಪ್ಲಿಕೇಶನ್ ಪ್ರದೇಶವನ್ನು ಹೊಂದಿದೆ. ಉದಾಹರಣೆಗೆ, ಮೀಥೈಲ್ ವೈಲೆಟ್ 0.13 - 0.5 pH ವ್ಯಾಪ್ತಿಯಲ್ಲಿ ಹಳದಿ ಬಣ್ಣದಿಂದ ಹಸಿರು ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತದೆ; ಮೀಥೈಲ್ ಕಿತ್ತಳೆ - ಕೆಂಪು ಬಣ್ಣದಿಂದ (pH< 3,1) до оранжево-желтой (рН 4); бромтимоловый синий – от желтой (рН < 6,0) до сине-фиолетовой (рН 7,0); фенолфталеин – от бесцветной (рН < 8,2) до малиновой (рН 10); тринитробензол – от бесцветной (pH < 12,2) до оранжевой (рН 14,0).
ಪ್ರಯೋಗಾಲಯಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಸಾರ್ವತ್ರಿಕ ಸೂಚಕಗಳನ್ನು ಬಳಸುತ್ತವೆ - ಹಲವಾರು ಪ್ರತ್ಯೇಕ ಸೂಚಕಗಳ ಮಿಶ್ರಣವನ್ನು ಆಯ್ಕೆಮಾಡಲಾಗುತ್ತದೆ ಇದರಿಂದ ಅವುಗಳ ಪರಿಹಾರವು ಪರ್ಯಾಯವಾಗಿ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತದೆ, ದ್ರಾವಣದ ಆಮ್ಲೀಯತೆಯು ವ್ಯಾಪಕವಾದ pH ವ್ಯಾಪ್ತಿಯಲ್ಲಿ ಬದಲಾದಾಗ ಮಳೆಬಿಲ್ಲಿನ ಎಲ್ಲಾ ಬಣ್ಣಗಳ ಮೂಲಕ ಹಾದುಹೋಗುತ್ತದೆ (ಉದಾಹರಣೆಗೆ, 1 ರಿಂದ 11 ರವರೆಗೆ. ) ಕಾಗದದ ಪಟ್ಟಿಗಳನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಸಾರ್ವತ್ರಿಕ ಸೂಚಕದ ದ್ರಾವಣದಿಂದ ತುಂಬಿಸಲಾಗುತ್ತದೆ, ಇದು ತ್ವರಿತವಾಗಿ (ಹೆಚ್ಚು ನಿಖರತೆಯಿಲ್ಲದಿದ್ದರೂ) ದ್ರಾವಣದಲ್ಲಿ ನೆನೆಸಿದ ಪಟ್ಟಿಯ ಬಣ್ಣವನ್ನು ಉಲ್ಲೇಖದ ಬಣ್ಣದೊಂದಿಗೆ ಹೋಲಿಸುವ ಮೂಲಕ ವಿಶ್ಲೇಷಿಸುವ ಪರಿಹಾರದ pH ಅನ್ನು ನಿರ್ಧರಿಸಲು ಅನುವು ಮಾಡಿಕೊಡುತ್ತದೆ. ಪ್ರಮಾಣದ.
ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕಗಳ ಜೊತೆಗೆ, ಇತರ ರೀತಿಯ ಸೂಚಕಗಳನ್ನು ಸಹ ಬಳಸಲಾಗುತ್ತದೆ. ಹೀಗಾಗಿ, ರೆಡಾಕ್ಸ್ ಸೂಚಕಗಳು ಆಕ್ಸಿಡೈಸಿಂಗ್ ಏಜೆಂಟ್ ಅಥವಾ ಕಡಿಮೆಗೊಳಿಸುವ ಏಜೆಂಟ್ ದ್ರಾವಣದಲ್ಲಿ ಇರುತ್ತವೆಯೇ ಎಂಬುದನ್ನು ಅವಲಂಬಿಸಿ ಅವುಗಳ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತವೆ. ಉದಾಹರಣೆಗೆ, ಡಿಫೆನೈಲಮೈನ್ನ ಆಕ್ಸಿಡೀಕೃತ ರೂಪವು ನೇರಳೆ ಬಣ್ಣದ್ದಾಗಿದ್ದರೆ, ಕಡಿಮೆಯಾದ ರೂಪವು ಬಣ್ಣರಹಿತವಾಗಿರುತ್ತದೆ. ಕೆಲವು ಆಕ್ಸಿಡೈಸಿಂಗ್ ಏಜೆಂಟ್ಗಳು ಸ್ವತಃ ಸೂಚಕಗಳಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತವೆ. ಉದಾಹರಣೆಗೆ, ಪ್ರತಿಕ್ರಿಯೆಯ ಸಮಯದಲ್ಲಿ ಕಬ್ಬಿಣದ (II) ಸಂಯುಕ್ತಗಳನ್ನು ವಿಶ್ಲೇಷಿಸುವಾಗ
10FeSO 4 + 2KMnO 4 + 8H 2 SO 4? 5Fe 2 (SO 4) 3 + 2MnSO 4 + K 2 SO 4 + 8H 2 O
ದ್ರಾವಣದಲ್ಲಿ Fe 2+ ಅಯಾನುಗಳು ಇರುವವರೆಗೆ ಸೇರಿಸಿದ ಪರ್ಮಾಂಗನೇಟ್ ದ್ರಾವಣವು ಬಣ್ಣಬಣ್ಣವಾಗುತ್ತದೆ. ಸ್ವಲ್ಪ ಹೆಚ್ಚಿನ ಪರ್ಮಾಂಗನೇಟ್ ಕಾಣಿಸಿಕೊಂಡ ತಕ್ಷಣ, ದ್ರಾವಣವು ಗುಲಾಬಿ ಬಣ್ಣಕ್ಕೆ ತಿರುಗುತ್ತದೆ. ಸೇವಿಸಿದ ಪರ್ಮಾಂಗನೇಟ್ ಪ್ರಮಾಣವನ್ನು ಆಧರಿಸಿ, ದ್ರಾವಣದಲ್ಲಿ ಕಬ್ಬಿಣದ ಅಂಶವನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡುವುದು ಸುಲಭ. ಅಂತೆಯೇ, ಅಯೋಡೋಮೆಟ್ರಿ ವಿಧಾನವನ್ನು ಬಳಸಿಕೊಂಡು ಹಲವಾರು ವಿಶ್ಲೇಷಣೆಗಳಲ್ಲಿ, ಅಯೋಡಿನ್ ಸ್ವತಃ ಸೂಚಕವಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ; ವಿಶ್ಲೇಷಣೆಯ ಸೂಕ್ಷ್ಮತೆಯನ್ನು ಹೆಚ್ಚಿಸಲು, ಪಿಷ್ಟವನ್ನು ಬಳಸಲಾಗುತ್ತದೆ, ಇದು ಅಯೋಡಿನ್ನ ಸಣ್ಣದೊಂದು ಅಧಿಕವನ್ನು ಪತ್ತೆಹಚ್ಚಲು ಸಾಧ್ಯವಾಗಿಸುತ್ತದೆ.
ಕಾಂಪ್ಲೆಕ್ಸೋಮೆಟ್ರಿಕ್ ಸೂಚಕಗಳನ್ನು ವ್ಯಾಪಕವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ - ಲೋಹದ ಅಯಾನುಗಳೊಂದಿಗೆ ಬಣ್ಣದ ಸಂಕೀರ್ಣ ಸಂಯುಕ್ತಗಳನ್ನು ರೂಪಿಸುವ ವಸ್ತುಗಳು (ಅವುಗಳಲ್ಲಿ ಹಲವು ಬಣ್ಣರಹಿತವಾಗಿವೆ). ಎರಿಯೋಕ್ರೋಮ್ ಕಪ್ಪು ಟಿ ಒಂದು ಉದಾಹರಣೆಯಾಗಿದೆ; ಈ ಸಂಕೀರ್ಣದ ಪರಿಹಾರ ಸಾವಯವ ಸಂಯುಕ್ತನೀಲಿ ಬಣ್ಣವನ್ನು ಹೊಂದಿದೆ, ಮತ್ತು ಮೆಗ್ನೀಸಿಯಮ್, ಕ್ಯಾಲ್ಸಿಯಂ ಮತ್ತು ಇತರ ಕೆಲವು ಅಯಾನುಗಳ ಉಪಸ್ಥಿತಿಯಲ್ಲಿ, ಸಂಕೀರ್ಣಗಳು ರೂಪುಗೊಳ್ಳುತ್ತವೆ, ಅದು ತೀವ್ರವಾಗಿ ವೈನ್-ಕೆಂಪು ಬಣ್ಣವನ್ನು ಹೊಂದಿರುತ್ತದೆ. ವಿಶ್ಲೇಷಣೆಯನ್ನು ಈ ಕೆಳಗಿನಂತೆ ನಡೆಸಲಾಗುತ್ತದೆ: ಟ್ರಿಲೋನ್ ಬಿ, ಹೆಚ್ಚಾಗಿ, ಸೂಚಕಕ್ಕಿಂತ ಪ್ರಬಲವಾಗಿದೆ, ಇದು ಟ್ರಿಲೋನ್ ಎಲ್ಲಾ ಲೋಹದ ಕ್ಯಾಟಯಾನುಗಳನ್ನು ಸಂಪೂರ್ಣವಾಗಿ ಬಂಧಿಸಿದ ತಕ್ಷಣ, ವಿಶ್ಲೇಷಿತ ಕ್ಯಾಟಯಾನುಗಳು ಮತ್ತು ಸೂಚಕವನ್ನು ಹೊಂದಿರುವ ದ್ರಾವಣಕ್ಕೆ ಡ್ರಾಪ್ವೈಸ್ನಲ್ಲಿ ಸೇರಿಸಲಾಗುತ್ತದೆ ಕೆಂಪು ಬಣ್ಣದಿಂದ ನೀಲಿ ಬಣ್ಣಕ್ಕೆ ಪರಿವರ್ತನೆ ಸಂಭವಿಸುತ್ತದೆ. ಸೇರಿಸಿದ ಟ್ರಿಲೋನ್ ಪ್ರಮಾಣವನ್ನು ಆಧರಿಸಿ, ದ್ರಾವಣದಲ್ಲಿ ಲೋಹದ ಕ್ಯಾಟಯಾನುಗಳ ವಿಷಯವನ್ನು ಲೆಕ್ಕಾಚಾರ ಮಾಡುವುದು ಸುಲಭ.
ಇತರ ರೀತಿಯ ಸೂಚಕಗಳು ಸಹ ತಿಳಿದಿವೆ. ಉದಾಹರಣೆಗೆ, ಕೆಲವು ಪದಾರ್ಥಗಳು ಕೆಸರಿನ ಮೇಲ್ಮೈಯಲ್ಲಿ ಹೀರಿಕೊಳ್ಳಲ್ಪಡುತ್ತವೆ, ಅದರ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತವೆ; ಅಂತಹ ಸೂಚಕಗಳನ್ನು ಹೊರಹೀರುವಿಕೆ ಸೂಚಕಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಮೋಡ ಅಥವಾ ಬಣ್ಣದ ದ್ರಾವಣಗಳನ್ನು ಟೈಟ್ರೇಟ್ ಮಾಡುವಾಗ, ಸಾಂಪ್ರದಾಯಿಕ ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕಗಳ ಬಣ್ಣದಲ್ಲಿ ಬದಲಾವಣೆಯನ್ನು ಗಮನಿಸುವುದು ಅಸಾಧ್ಯವಾದಾಗ, ಪ್ರತಿದೀಪಕ ಸೂಚಕಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ. ಅವು ಹೊಳೆಯುತ್ತವೆ (ಪ್ರತಿದೀಪಕ) ವಿವಿಧ ಬಣ್ಣಗಳುದ್ರಾವಣದ pH ಅನ್ನು ಅವಲಂಬಿಸಿ. ಉದಾಹರಣೆಗೆ, ಆಕ್ರಿಡಿನ್ ಪ್ರತಿದೀಪಕವು pH = 4.5 ನಲ್ಲಿ ಹಸಿರು ಬಣ್ಣದಿಂದ pH = 5.5 ನಲ್ಲಿ ನೀಲಿ ಬಣ್ಣಕ್ಕೆ ಬದಲಾಗುತ್ತದೆ; ಸೂಚಕದ ಹೊಳಪು ಪರಿಹಾರದ ಪಾರದರ್ಶಕತೆ ಮತ್ತು ಆಂತರಿಕ ಬಣ್ಣವನ್ನು ಅವಲಂಬಿಸಿರುವುದಿಲ್ಲ ಎಂಬುದು ಮುಖ್ಯ.
ಇಲ್ಯಾ ಲೀನ್ಸನ್
ಸೂಚಕಗಳು(ಲೇಟ್ ಲ್ಯಾಟ್. ಸೂಚಕ - ಪಾಯಿಂಟರ್), ರಾಸಾಯನಿಕ. ವಸ್ತುವಿನ ಸಾಂದ್ರತೆಯು ಬದಲಾದಾಗ ಬಣ್ಣ, ಪ್ರಕಾಶಮಾನತೆ ಅಥವಾ ಅವಕ್ಷೇಪವನ್ನು ಬದಲಾಯಿಸುವ ವಸ್ತುಗಳು. ದ್ರಾವಣದಲ್ಲಿ ಘಟಕ. ವ್ಯವಸ್ಥೆಯ ನಿರ್ದಿಷ್ಟ ಸ್ಥಿತಿಯನ್ನು ಅಥವಾ ಈ ಸ್ಥಿತಿಯನ್ನು ತಲುಪಿದಾಗ ಕ್ಷಣವನ್ನು ಸೂಚಿಸಿ. ಹಿಂತಿರುಗಿಸಬಹುದಾದ ಮತ್ತು ಬದಲಾಯಿಸಲಾಗದ ಸೂಚಕಗಳು ಇವೆ. ವ್ಯವಸ್ಥೆಯ ಸ್ಥಿತಿಯು ಬದಲಾದಾಗ ಮೊದಲಿನ ಬಣ್ಣದಲ್ಲಿ ಬದಲಾವಣೆ (ಉದಾಹರಣೆಗೆ, ಮಾಧ್ಯಮದ pH ಬದಲಾದಾಗ ಫೀನಾಲ್ಫ್ಥೇಲಿನ್). ಅನೇಕ ಬಾರಿ ಪುನರಾವರ್ತಿಸಲಾಗಿದೆ. ಬದಲಾಯಿಸಲಾಗದ ಸೂಚಕಗಳು ಬದಲಾಯಿಸಲಾಗದ ರಸಾಯನಶಾಸ್ತ್ರಕ್ಕೆ ಒಳಪಟ್ಟಿರುತ್ತವೆ. ರೂಪಾಂತರಗಳು, ಉದಾಹರಣೆಗೆ, BrO 3 ಅಯಾನುಗಳೊಂದಿಗೆ ಆಕ್ಸಿಡೀಕರಣದ ಸಮಯದಲ್ಲಿ ಅಜೋ ಸಂಯುಕ್ತಗಳು - ನಾಶವಾಗುತ್ತವೆ. ಅಧ್ಯಯನದ ಅಡಿಯಲ್ಲಿ ಪರಿಹಾರಕ್ಕೆ ಪರಿಚಯಿಸಲಾದ ಸೂಚಕಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ. ಆಂತರಿಕ, ಬಾಹ್ಯಕ್ಕೆ ವ್ಯತಿರಿಕ್ತವಾಗಿ, ವಿಶ್ಲೇಷಿಸಿದ ಮಿಶ್ರಣದ ಹೊರಗೆ ಕಾರ್ಯವಿಧಾನವನ್ನು ನಡೆಸಲಾಗುತ್ತದೆ. ನಂತರದ ಸಂದರ್ಭದಲ್ಲಿ, ಒಂದು ಅಥವಾ ಹೆಚ್ಚು. ವಿಶ್ಲೇಷಿಸಿದ ದ್ರಾವಣದ ಹನಿಗಳನ್ನು ಸೂಚಕದಲ್ಲಿ ನೆನೆಸಿದ ಕಾಗದದ ತುಂಡು ಮೇಲೆ ಇರಿಸಲಾಗುತ್ತದೆ ಅಥವಾ ಸೂಚಕದ ಡ್ರಾಪ್ನೊಂದಿಗೆ ಬಿಳಿ ಪಿಂಗಾಣಿ ತಟ್ಟೆಯಲ್ಲಿ ಮಿಶ್ರಣ ಮಾಡಲಾಗುತ್ತದೆ.ಮತ್ತು ಜನಸಂಖ್ಯೆಯ ಅಂತ್ಯವನ್ನು ನಿರ್ಧರಿಸಲು ಸೂಚಕಗಳನ್ನು ಹೆಚ್ಚಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ರಾಸಾಯನಿಕ ಜಿಲ್ಲೆಗಳು, ಚ. ಅರ್. ಟೈಟರೇಶನ್ನ ಅಂತಿಮ ಬಿಂದು (t.t.t.). ಟೈಟ್ರಿಮೆಟ್ರಿಕ್ ಪ್ರಕಾರ ವಿಧಾನಗಳು ಆಮ್ಲ-ಬೇಸ್, ಹೊರಹೀರುವಿಕೆ, ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತದ ನಡುವೆ ವ್ಯತ್ಯಾಸವನ್ನು ತೋರಿಸುತ್ತವೆ. ಮತ್ತು ಸಂಕೀರ್ಣ. ಸೂಚಕಗಳು. p-rime org ಸಂಯುಕ್ತಗಳಾಗಿವೆ, ಇದು H + ಅಯಾನುಗಳ (ಪರಿಸರದ pH) ಸಾಂದ್ರತೆಯನ್ನು ಅವಲಂಬಿಸಿ ಅವುಗಳ ಬಣ್ಣ ಅಥವಾ ಪ್ರಕಾಶಮಾನತೆಯನ್ನು ಬದಲಾಯಿಸುತ್ತದೆ. ಅಪ್ಲಿಕೇಶನ್ ಸಂಯುಕ್ತಗಳು ಮತ್ತು ಬೇಸ್ಗಳ ನಡುವಿನ ಪರಿಹಾರದ ಅಂತ್ಯವನ್ನು ಸ್ಥಾಪಿಸಲು (ಆಸಿಡ್-ಬೇಸ್ ಟೈಟರೇಶನ್ ಸಮಯದಲ್ಲಿ ಸೇರಿದಂತೆ) ಅಥವಾ ಇತರ ಪರಿಹಾರಗಳು H + ಅಯಾನುಗಳನ್ನು ಒಳಗೊಂಡಿದ್ದರೆ, ಹಾಗೆಯೇ ವರ್ಣಮಾಪನಕ್ಕಾಗಿ. ನೀರಿನ ದ್ರಾವಣಗಳ pH ಅನ್ನು ನಿರ್ಧರಿಸುವುದು. ನಾಯಬ್. ಪ್ರಮುಖ ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕಗಳನ್ನು ಕೋಷ್ಟಕದಲ್ಲಿ ನೀಡಲಾಗಿದೆ. 1. ಸೂಚಕಗಳ ಬಣ್ಣದಲ್ಲಿನ ಬದಲಾವಣೆಗೆ ಕಾರಣವೆಂದರೆ ಅದರ ಅಣುಗಳಿಂದ ಪ್ರೋಟಾನ್ಗಳ ಸೇರ್ಪಡೆ ಅಥವಾ ದಾನವು ಕೆಲವು ಕ್ರೋಮೋಫೋರ್ ಗುಂಪುಗಳನ್ನು ಇತರರಿಂದ ಬದಲಾಯಿಸುವುದರೊಂದಿಗೆ ಅಥವಾ ಹೊಸ ಕ್ರೋಮೋಫೋರ್ ಗುಂಪುಗಳ ಗೋಚರಿಸುವಿಕೆಯೊಂದಿಗೆ ಸಂಬಂಧಿಸಿದೆ. ಸೂಚಕವು HIN ನ ದುರ್ಬಲ ಮೌಲ್ಯವನ್ನು ಹೊಂದಿದ್ದರೆ, ನಂತರ ಜಲೀಯ ದ್ರಾವಣದಲ್ಲಿ ಸಮತೋಲನವಿದೆ: HIN + H 2 Oಡಿ ಇನ್ - + H 3 O + . ಸೂಚಕವು ದುರ್ಬಲ ಬೇಸ್ In ಆಗಿದ್ದರೆ, ನಂತರ: In + H 2 O D HIN + + OH - . IN ಸಾಮಾನ್ಯ ನೋಟಬರೆಯಬಹುದು: a + H 2 O ನಲ್ಲಿಡಿ b + H 3 O + ನಲ್ಲಿ, ಅಲ್ಲಿ a ಮತ್ತು In b - ಕ್ರಮವಾಗಿ. ಸೂಚಕದ ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ರೂಪಗಳು, ಅವು ವಿಭಿನ್ನವಾಗಿ ಬಣ್ಣವನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಈ ಪ್ರಕ್ರಿಯೆಯ ಸಮತೋಲನ ಸ್ಥಿರಾಂಕವು K ln = / ಎಂದು ಕರೆಯಲ್ಪಡುತ್ತದೆ. ಸೂಚಕ ಸ್ಥಿರ. ದ್ರಾವಣದ ಬಣ್ಣವು ಅನುಪಾತವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ /, ಇದನ್ನು ದ್ರಾವಣದ pH ನಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ.ಅದರ ಸಾಂದ್ರತೆಯು ಇತರ ರೂಪದ ಸಾಂದ್ರತೆಗಿಂತ 10 ಪಟ್ಟು ಹೆಚ್ಚಿದ್ದರೆ ಸೂಚಕದ ಒಂದು ರೂಪದ ಬಣ್ಣವು ಗಮನಾರ್ಹವಾಗಿದೆ ಎಂದು ನಂಬಲಾಗಿದೆ, ಅಂದರೆ. / = / K ln ಅನುಪಾತವು 0.1 ಅಥವಾ 10 ಆಗಿದ್ದರೆ. ಸೂಚಕದ ಬಣ್ಣದಲ್ಲಿನ ಬದಲಾವಣೆಯನ್ನು pH = pK ln b 1 ಪ್ರದೇಶದಲ್ಲಿ ಗುರುತಿಸಲಾಗಿದೆ, ಇದನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ. ಸೂಚಕ ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರ. ಗರಿಷ್ಠ ಬದಲಾವಣೆ. ಸ್ಪಷ್ಟವಾಗಿ ಯಾವಾಗ = ಮತ್ತು K ln = [H 3 O] +, ಅಂದರೆ. pH = pK ln ನಲ್ಲಿ. ಟೈಟರೇಶನ್ ಸಾಮಾನ್ಯವಾಗಿ ಕೊನೆಗೊಳ್ಳುವ pH ಮೌಲ್ಯವನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ. ಟೈಟರೇಶನ್ ಸೂಚ್ಯಂಕ pT. ಬಣ್ಣ ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರವು ಸಮಾನತೆಯ ಹಂತದಲ್ಲಿ ಪರಿಹಾರವು ಹೊಂದಿರಬೇಕಾದ pH ಮೌಲ್ಯವನ್ನು ಒಳಗೊಂಡಿರುವ ರೀತಿಯಲ್ಲಿ ಟೈಟರೇಶನ್ಗಾಗಿ ಸೂಚಕಗಳನ್ನು ಆಯ್ಕೆಮಾಡಲಾಗುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ಈ pH ಮೌಲ್ಯವು ಬಳಸಿದ ಸೂಚಕದ pH ನೊಂದಿಗೆ ಹೊಂದಿಕೆಯಾಗುವುದಿಲ್ಲ, ಇದು ಕರೆಯಲ್ಪಡುವ ಕಾರಣಕ್ಕೆ ಕಾರಣವಾಗುತ್ತದೆ. ಸೂಚಕ ದೋಷ. c.t.t. ಯಲ್ಲಿ ಹೆಚ್ಚು ಟೈಟ್ರೇಟೆಡ್ ದುರ್ಬಲ ಬೇಸ್ ಅಥವಾ ಸಂಯುಕ್ತಗಳು ಉಳಿದಿದ್ದರೆ, ದೋಷವನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ. ವಿಶ್ರಾಂತಿ ಮೂಲ ಅಥವಾ ಆಮ್ಲೀಯ.
ಸೂಚಕದ ಸೂಕ್ಷ್ಮತೆಯು ಅಯಾನಿನ ಸಾಂದ್ರತೆಯನ್ನು (mol/l ನಲ್ಲಿ) ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ (ಈ ಸಂದರ್ಭದಲ್ಲಿ, H + ಅಥವಾ OH -
) ಗರಿಷ್ಠ ಹಂತದಲ್ಲಿ. ಹಠಾತ್ ಬಣ್ಣ ಪರಿವರ್ತನೆ. ಇವೆ: ಕ್ಷಾರೀಯ pH ಮೌಲ್ಯಗಳ ಪ್ರದೇಶದಲ್ಲಿ ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರದೊಂದಿಗೆ ಆಮ್ಲಗಳಿಗೆ ಸೂಕ್ಷ್ಮವಾಗಿರುವ ಸೂಚಕಗಳು (ಉದಾಹರಣೆಗೆ, ಫೀನಾಲ್ಫ್ಥಲೀನ್, ಥೈಮೊಲ್ಫ್ಥಲೀನ್); ಆಮ್ಲೀಯ ಪ್ರದೇಶದಲ್ಲಿ ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರದೊಂದಿಗೆ ಬೇಸ್-ಸೆನ್ಸಿಟಿವ್ ಸೂಚಕಗಳು (ಡೈಮಿಥೈಲ್ ಹಳದಿ, ಮೀಥೈಲ್ ಕಿತ್ತಳೆ, ಇತ್ಯಾದಿ); ತಟಸ್ಥ ಸೂಚಕಗಳು, ಇದರ ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರವು ಅಂದಾಜು. pH 7 (ತಟಸ್ಥ ಕೆಂಪು, ಫೀನಾಲ್ ಕೆಂಪು, ಇತ್ಯಾದಿ).ಮತ್ತು ಸೂಚಕಗಳು ಒಂದು ಅಥವಾ ಎರಡು ಬಣ್ಣದ ಆಕಾರಗಳಲ್ಲಿ ಬರುತ್ತವೆ; ಅಂತಹ ಸೂಚಕಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ವಿಶ್ರಾಂತಿ ಏಕ-ಬಣ್ಣ ಮತ್ತು ಎರಡು-ಬಣ್ಣ. ನಾಯಬ್. ಆಮ್ಲೀಯ ಮತ್ತು ಮೂಲ ರೂಪಗಳು ಪೂರಕ ಬಣ್ಣ ಹೊಂದಿರುವ ಸೂಚಕಗಳಲ್ಲಿ ಬಣ್ಣದಲ್ಲಿ ಸ್ಪಷ್ಟ ಬದಲಾವಣೆಯನ್ನು ಗಮನಿಸಬಹುದು. ಬಣ್ಣಗಳು. ಆದಾಗ್ಯೂ, ಅಂತಹ ಸೂಚಕಗಳು ಅಸ್ತಿತ್ವದಲ್ಲಿಲ್ಲ. ಆದ್ದರಿಂದ, ಬಣ್ಣವನ್ನು ಸೇರಿಸುವ ಮೂಲಕ, ಎರಡೂ ರೂಪಗಳ ಬಣ್ಣಗಳನ್ನು ತಕ್ಕಂತೆ ಬದಲಾಯಿಸಲಾಗುತ್ತದೆ. ಹೀಗಾಗಿ, ಮೀಥೈಲ್ ಕೆಂಪು ಬಣ್ಣಕ್ಕೆ, ಕೆಂಪು ಬಣ್ಣದಿಂದ ಹಳದಿಗೆ ಪರಿವರ್ತನೆಯು 2 pH ಘಟಕಗಳ ವ್ಯಾಪ್ತಿಯಲ್ಲಿ ಸಂಭವಿಸುತ್ತದೆ ಮತ್ತು ಮಿಥಿಲೀನ್ ನೀಲಿ ಬಣ್ಣವನ್ನು ದ್ರಾವಣಕ್ಕೆ ಸೇರಿಸಿದರೆ, ನಂತರ ಕೆಂಪು-ನೇರಳೆಯಿಂದ ಹಸಿರು ಬಣ್ಣಕ್ಕೆ ಬಣ್ಣ ಪರಿವರ್ತನೆಯು pH 5.3 ನಲ್ಲಿ ತೀವ್ರವಾಗಿ ಮತ್ತು ಸ್ಪಷ್ಟವಾಗಿ ಕಂಡುಬರುತ್ತದೆ. ನೀವು ಎರಡು ಸೂಚಕಗಳ ಮಿಶ್ರಣವನ್ನು ಬಳಸಿದರೆ ಇದೇ ರೀತಿಯ ಪರಿಣಾಮವನ್ನು ಸಾಧಿಸಬಹುದು, ಅದರ ಬಣ್ಣಗಳು ಇನ್ನೊಂದಕ್ಕೆ ಪೂರಕವಾಗಿರುತ್ತವೆ. ಸ್ನೇಹಿತ. ಅಂತಹ ಸೂಚಕಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ ಮಿಶ್ರ (ಕೋಷ್ಟಕ 2).

1 ರಿಂದ 14 ರವರೆಗಿನ ಸಂಪೂರ್ಣ pH ವ್ಯಾಪ್ತಿಯಲ್ಲಿ ತಮ್ಮ ಬಣ್ಣವನ್ನು ನಿರಂತರವಾಗಿ ಬದಲಾಯಿಸುವ ಸೂಚಕಗಳ ಮಿಶ್ರಣಗಳನ್ನು ಕರೆಯಲಾಗುತ್ತದೆ. ಸಾರ್ವತ್ರಿಕ. ಅವುಗಳನ್ನು ಸುಮಾರು ಬಳಸಲಾಗುತ್ತದೆ. ಪರಿಹಾರಗಳ pH ನ ಮೌಲ್ಯಮಾಪನ.
ಸೂಚಕದ ಬಣ್ಣದಲ್ಲಿನ ಬದಲಾವಣೆಯು ಅದರ ಸಾಂದ್ರತೆಯಿಂದ ಪ್ರಭಾವಿತವಾಗಿರುತ್ತದೆ. ಎರಡು-ಬಣ್ಣದ ಸೂಚಕಗಳಿಗೆ, ಹೆಚ್ಚಿನ ಸಾಂದ್ರತೆ, ಕಡಿಮೆ ನಾಟಕೀಯ ಬಣ್ಣ ಬದಲಾವಣೆ, ಏಕೆಂದರೆ ಎರಡೂ ರೂಪಗಳ ಹೀರಿಕೊಳ್ಳುವ ವರ್ಣಪಟಲವು ಹೆಚ್ಚಿನ ಪ್ರಮಾಣದಲ್ಲಿ ಪರಸ್ಪರ ಅತಿಕ್ರಮಿಸುತ್ತದೆ ಮತ್ತು ಬಣ್ಣ ಬದಲಾವಣೆಯನ್ನು ಪತ್ತೆಹಚ್ಚಲು ಹೆಚ್ಚು ಕಷ್ಟವಾಗುತ್ತದೆ. ಸಾಮಾನ್ಯವಾಗಿ ಅದೇ ಕನಿಷ್ಠ (ಪರಿಹಾರದ ಹಲವಾರು ಹನಿಗಳು) ಸೂಚಕದ ಪ್ರಮಾಣವನ್ನು ಬಳಸಲಾಗುತ್ತದೆ.
ಅನೇಕ ಸೂಚಕಗಳ ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರವು ತಾಪಮಾನವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ. ಹೀಗಾಗಿ, ಮೀಥೈಲ್ ಕಿತ್ತಳೆ ಅದರ ಬಣ್ಣವನ್ನು ಕೋಣೆಯ ಉಷ್ಣಾಂಶದಲ್ಲಿ 3.4-4.4 ರ pH ವ್ಯಾಪ್ತಿಯಲ್ಲಿ ಮತ್ತು 100 ° C ನಲ್ಲಿ 2.5-3.3 ರ pH ವ್ಯಾಪ್ತಿಯಲ್ಲಿ ಬದಲಾಯಿಸುತ್ತದೆ. ಇದು ನೀರಿನ ಅಯಾನಿಕ್ ಉತ್ಪನ್ನದಲ್ಲಿನ ಬದಲಾವಣೆಯಿಂದಾಗಿ.
ದ್ರಾವಣದಲ್ಲಿ ಇರುವ ಕೊಲೊಯ್ಡಲ್ ಕಣಗಳು ಆಡ್ಸರ್ಬ್ ಸೂಚಕಗಳು, ಇದು ಅದರ ಬಣ್ಣದಲ್ಲಿ ಸಂಪೂರ್ಣ ಬದಲಾವಣೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ. ಉಪಸ್ಥಿತಿಯಲ್ಲಿ ದೋಷಗಳನ್ನು ತೊಡೆದುಹಾಕಲು. ಧನಾತ್ಮಕ ಆವೇಶದ ಕೊಲೊಯ್ಡಲ್ ಕಣಗಳು, ಮೂಲ ಸೂಚಕಗಳನ್ನು ಬಳಸಬೇಕು ಮತ್ತು ಇದ್ದರೆ. ಋಣಾತ್ಮಕ ಚಾರ್ಜ್ - ಆಮ್ಲ ಸೂಚಕಗಳು.
ಸಾಮಾನ್ಯ ಪರಿಸ್ಥಿತಿಗಳಲ್ಲಿ ಟೈಟ್ರೇಟ್ ಮಾಡುವಾಗ, ಕರಗಿದ CO 2 ನ ಪ್ರಭಾವವನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳುವುದು ಅವಶ್ಯಕ, ವಿಶೇಷವಾಗಿ pK ln> 4 ನೊಂದಿಗೆ ಸೂಚಕಗಳನ್ನು ಬಳಸುವಾಗ (ಉದಾಹರಣೆಗೆ, ಮೀಥೈಲ್ ಕಿತ್ತಳೆ, ಮೀಥೈಲ್ ಕೆಂಪು, ಫೀನಾಲ್ಫ್ಥಲೀನ್). ಕೆಲವೊಮ್ಮೆ CO 2 ಅನ್ನು ಮೊದಲು ಕುದಿಯುವ ಮೂಲಕ ತೆಗೆದುಹಾಕಲಾಗುತ್ತದೆ ಅಥವಾ ವಾತಾವರಣದ ಸಂಪರ್ಕದ ಅನುಪಸ್ಥಿತಿಯಲ್ಲಿ ದ್ರಾವಣವನ್ನು ಟೈಟ್ರೇಟ್ ಮಾಡಲಾಗುತ್ತದೆ.
ಬಾಹ್ಯ ತಟಸ್ಥ ವಿದ್ಯುದ್ವಿಚ್ಛೇದ್ಯಗಳ (ಉಪ್ಪು ಪರಿಣಾಮ) ಪ್ರಭಾವವು ಸೂಚಕಗಳ ಸಮತೋಲನದಲ್ಲಿನ ಬದಲಾವಣೆಯಲ್ಲಿ ಸ್ವತಃ ಪ್ರಕಟವಾಗುತ್ತದೆ. ಆಮ್ಲ ಸೂಚಕಗಳ ಸಂದರ್ಭದಲ್ಲಿ, ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರವು ಹೆಚ್ಚು ಆಮ್ಲೀಯ ಪ್ರದೇಶಕ್ಕೆ ಮತ್ತು ಮೂಲ ಸೂಚಕಗಳ ಸಂದರ್ಭದಲ್ಲಿ ಹೆಚ್ಚು ಕ್ಷಾರೀಯ ಪ್ರದೇಶಕ್ಕೆ ಬದಲಾಗುತ್ತದೆ.
ದ್ರಾವಕದ ಸ್ವರೂಪವನ್ನು ಅವಲಂಬಿಸಿ, ಸೂಚಕಗಳ ಬಣ್ಣಗಳು, ಅವುಗಳ pK ln ಮತ್ತು ಸೂಕ್ಷ್ಮತೆಯು ಬದಲಾಗುತ್ತದೆ. ಹೀಗಾಗಿ, ನೀರಿನಲ್ಲಿ ಮೀಥೈಲ್ ಕೆಂಪು ಬ್ರೋಮೊಫೆನಾಲ್ ನೀಲಿಗಿಂತ H + ಅಯಾನ್ ಚಟುವಟಿಕೆಯ ಹೆಚ್ಚಿನ ಮೌಲ್ಯಗಳಲ್ಲಿ ಬಣ್ಣ ಪರಿವರ್ತನೆಯನ್ನು ನೀಡುತ್ತದೆ ಮತ್ತು ಎಥಿಲೀನ್ ಗ್ಲೈಕಾಲ್ ದ್ರಾವಣದಲ್ಲಿ ಪ್ರತಿಯಾಗಿ. ನೀರು-ಮೆಥನಾಲ್ ಮತ್ತು ನೀರು-ಎಥೆನಾಲ್ ದ್ರಾವಣಗಳಲ್ಲಿ, ಜಲವಾಸಿ ಪರಿಸರಕ್ಕೆ ಹೋಲಿಸಿದರೆ ಬದಲಾವಣೆಯು ಅತ್ಯಲ್ಪವಾಗಿದೆ. ಆಲ್ಕೊಹಾಲ್ಯುಕ್ತ ಪರಿಸರದಲ್ಲಿ, ಆಮ್ಲ ಸೂಚಕಗಳು ಮೂಲ ಸೂಚಕಗಳಿಗಿಂತ H + ಅಯಾನುಗಳಿಗೆ ಹೆಚ್ಚು ಸಂವೇದನಾಶೀಲವಾಗಿರುತ್ತವೆ.
ತಟಸ್ಥ ಮಾಧ್ಯಮದಲ್ಲಿ ಟೈಟ್ರೇಟ್ ಮಾಡುವಾಗ ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕವನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಗಾಜಿನ ಸೂಚಕ ವಿದ್ಯುದ್ವಾರವನ್ನು ಬಳಸಿಕೊಂಡು ಪೊಟೆನ್ಟಿಯೊಮೆಟ್ರಿಕ್ ಆಗಿ ಹೊಂದಿಸಲಾಗಿದೆ, ಆಸಿಡ್-ಬೇಸ್ ಸೂಚಕಗಳನ್ನು ಸಹ ಬಳಸಲಾಗುತ್ತದೆ (ಕೋಷ್ಟಕ 3).
ಹೆಚ್ಚಾಗಿ, ಡಯಾಕ್ಸೇನ್ನಲ್ಲಿ ಮೀಥೈಲ್ ಕೆಂಪು ಅಥವಾ ಜಲರಹಿತ CH 3 COOH ನಲ್ಲಿ ಸ್ಫಟಿಕ ನೇರಳೆಯನ್ನು ದುರ್ಬಲ ಬೇಸ್ಗಳ ಟೈಟರೇಶನ್ಗಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ; ದುರ್ಬಲ ಔಷಧಿಗಳನ್ನು ಟೈಟ್ರೇಟ್ ಮಾಡುವಾಗ - DMF ನಲ್ಲಿ ಥೈಮಾಲ್ ನೀಲಿ.
ಜಲೀಯವಲ್ಲದ ಸೂಚಕಗಳ ನಡವಳಿಕೆ ಮತ್ತು ಜಲ ಪರಿಸರಗಳುಅದೇ ರೀತಿ. ಉದಾಹರಣೆಗೆ, SH ದ್ರಾವಣದಲ್ಲಿ HIN ದುರ್ಬಲ ಮೌಲ್ಯಕ್ಕಾಗಿ ನಾವು ಸಮತೋಲನವನ್ನು ಬರೆಯಬಹುದು: HIN + SHಡಿ ಇನ್ - + SH 2 + . ಸೂಚಕಗಳ ಕ್ರಿಯೆಯ ಕಾರ್ಯವಿಧಾನವು ನೀರಿನಲ್ಲಿರುವಂತೆಯೇ ಇರುತ್ತದೆ, ಜಲೀಯವಲ್ಲದ ಮಾಧ್ಯಮದಲ್ಲಿ ಮಾತ್ರ ಅನುಗುಣವಾದ ಆಮ್ಲೀಯತೆಯ ಮಾಪಕಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ (pH p, pA; ಆಸಿಡ್-ಬೇಸ್ ಟೈಟರೇಶನ್ ನೋಡಿ).
ಲ್ಯುಮಿನೆಸೆಂಟ್ ಸೂಚಕಗಳನ್ನು ಆಮ್ಲ-ಬೇಸ್ ಸೂಚಕಗಳಾಗಿಯೂ ಬಳಸಲಾಗುತ್ತದೆ, pH ಅನ್ನು ಅವಲಂಬಿಸಿ ಬಣ್ಣ ಮತ್ತು ಪ್ರತಿದೀಪಕ ತೀವ್ರತೆಯನ್ನು ಬದಲಾಯಿಸುತ್ತದೆ ಮತ್ತು ಹೆಚ್ಚು ಬಣ್ಣದ ಮತ್ತು ಟರ್ಬಿಡ್ ದ್ರಾವಣಗಳ ಟೈಟರೇಶನ್ ಅನ್ನು ಅನುಮತಿಸುತ್ತದೆ.

ದುರ್ಬಲ ಸಂಯುಕ್ತಗಳ ಟೈಟರೇಶನ್ಗಾಗಿ, ಕರೆಯಲ್ಪಡುವ. ಪ್ರಕ್ಷುಬ್ಧತೆಯ ಸೂಚಕಗಳು, ಬಹಳ ಕಿರಿದಾದ pH ವ್ಯಾಪ್ತಿಯಲ್ಲಿ ಹೆಪ್ಪುಗಟ್ಟುವ ರಿವರ್ಸಿಬಲ್ ಕೊಲೊಯ್ಡಲ್ ವ್ಯವಸ್ಥೆಗಳನ್ನು ರೂಪಿಸುತ್ತವೆ (ಉದಾಹರಣೆಗೆ, ಐಸೋನಿಟ್ರೋಅಸೆಟೈಲ್-ಎನ್-ಅಮಿನೊಬೆಂಜೀನ್ pH 10.7-11.0 ನಲ್ಲಿ ಪ್ರಕ್ಷುಬ್ಧತೆಯನ್ನು ಉಂಟುಮಾಡುತ್ತದೆ). ಮೆಟಾಲೋಕ್ರೋಮಿಕ್ ಸೂಚಕಗಳೊಂದಿಗೆ ಲೋಹದ ಸಂಕೀರ್ಣಗಳನ್ನು ಆಮ್ಲ-ಬೇಸ್ ಸೂಚಕಗಳಾಗಿ ಬಳಸಬಹುದು (ಕೆಳಗೆ ನೋಡಿ); ಈ ಸಂಕೀರ್ಣಗಳು, ನಾಶವಾದಾಗ, ಕಿರಿದಾದ pH ವ್ಯಾಪ್ತಿಯಲ್ಲಿ ದ್ರಾವಣದ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುತ್ತವೆ.
org ಅನ್ನು ನಿರ್ಧರಿಸಲು. ಸೆಟ್ ಮತ್ತು ಬೇಸ್ಗಳು ನೀರಿನಲ್ಲಿ ಇರುತ್ತವೆ. ಅದರೊಂದಿಗೆ ಬೆರೆಯದ ದ್ರಾವಕ ಎಂದು ಕರೆಯಲ್ಪಡುತ್ತದೆ. ಉಭಯಚರ ಸೂಚಕಗಳು, ಇದು ಡಿಕಂಪ್ನೊಂದಿಗೆ ಸೂಚಕ ಆಮ್ಲಗಳ ಲವಣಗಳು (ಉದಾಹರಣೆಗೆ, ಟ್ರೋಪಿಯೋಲಿನ್ 00). org. ಬೇಸ್ಗಳು (ಉದಾ ಆಲ್ಕಲಾಯ್ಡ್ಗಳು). ಈ ಸೂಚಕಗಳು ಚೆನ್ನಾಗಿ ಕರಗುತ್ತವೆ. org ನಲ್ಲಿ. ಆರ್-ರೈಟಲ್ಸ್, ನೀರಿನಲ್ಲಿ ಕೆಟ್ಟದು; ಹೆಚ್ಚು ಸೂಕ್ಷ್ಮವಾಗಿರುತ್ತವೆ.
ಹೊರಹೀರುವಿಕೆ ಸೂಚಕಗಳು ಕೆಸರಿನ ಮೇಲ್ಮೈಯಲ್ಲಿ ಹೀರಿಕೊಳ್ಳುವ ಮತ್ತು ಪ್ರಕಾಶಮಾನತೆಯ ಬಣ್ಣ ಅಥವಾ ತೀವ್ರತೆಯನ್ನು ಬದಲಾಯಿಸಬಹುದಾದ ಪದಾರ್ಥಗಳಾಗಿವೆ ಮತ್ತು ಅವಕ್ಷೇಪನದ ಟೈಟರೇಶನ್ನಲ್ಲಿ ಮೊದಲನೆಯದು, ಸೆಡಿಮೆಂಟ್ ಅಯಾನುಗಳನ್ನು ಹೋಲುತ್ತವೆ ಕೆಸರು ಸ್ವತಃ, ಅದರ ನಂತರ ಸೂಚಕವನ್ನು ಹೀರಿಕೊಳ್ಳಲಾಗುತ್ತದೆ. ಸೂಚಕಗಳ ಒಂದು ದೊಡ್ಡ ಗುಂಪು ಬಣ್ಣಗಳು (ಟೇಬಲ್ 4), ಇದು ಕೆಸರು ಮೇಲ್ಮೈಯಿಂದ ಹೀರಿಕೊಳ್ಳಲ್ಪಟ್ಟಿದ್ದು, ಕೆಸರು ಒಳಗೊಂಡಿರುವ ಅಯಾನುಗಳೊಂದಿಗೆ ಲವಣಗಳನ್ನು ರೂಪಿಸುತ್ತದೆ.

ಉದಾಹರಣೆಗೆ, ಇಯೊಸಿನ್ ದ್ರಾವಣವು ಗುಲಾಬಿ ಬಣ್ಣವನ್ನು ಹೊಂದಿರುತ್ತದೆ, ಇದು AgNO 3 ಅನ್ನು ಸೇರಿಸಿದಾಗ ಬದಲಾಗುವುದಿಲ್ಲ. ಆದರೆ KBr ದ್ರಾವಣದೊಂದಿಗೆ ಟೈಟರೇಶನ್ ಸಮಯದಲ್ಲಿ, ಹೊರಬೀಳುವ ಅವಕ್ಷೇಪವು ಇಯೋಸಿನ್ ಅಯಾನುಗಳನ್ನು ಜೋಡಿಸುವ Ag + ಅಯಾನುಗಳನ್ನು ಹೀರಿಕೊಳ್ಳುತ್ತದೆ. ಅವಕ್ಷೇಪವು ಕೆಂಪು-ನೇರಳೆ ಆಗುತ್ತದೆ. c.t.t. ನಲ್ಲಿ, ಎಲ್ಲಾ Ag + ಅಯಾನುಗಳನ್ನು ಟೈಟ್ರೇಟ್ ಮಾಡಿದಾಗ, ಅವಕ್ಷೇಪದ ಬಣ್ಣವು ಕಣ್ಮರೆಯಾಗುತ್ತದೆ ಮತ್ತು ದ್ರಾವಣವು ಮತ್ತೆ ಗುಲಾಬಿಯಾಗುತ್ತದೆ.
ಇನೋರ್ಗ್. ಹೀರಿಕೊಳ್ಳುತ್ತದೆ. ಸೂಚಕಗಳು ಟೈಟ್ರಾಂಟ್ ಅಯಾನುಗಳೊಂದಿಗೆ ಬಣ್ಣದ ಅವಕ್ಷೇಪ ಅಥವಾ ಸಂಕೀರ್ಣವನ್ನು ರೂಪಿಸುತ್ತವೆ (ಉದಾಹರಣೆಗೆ, CrO 4 ಅಯಾನುಗಳನ್ನು ಸೂಚಕಗಳಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ- ಮತ್ತು SCN - ಅರ್ಜೆಂಟಮೆಟ್ರಿಯಲ್ಲಿ).
ಆಡ್ಸೋರ್ಬ್ಸ್ ಆಗಿ. ಕೆಲವು ಸೂಚಕಗಳನ್ನು ಸಹ ಬಳಸಲಾಗುತ್ತದೆ: ಆಮ್ಲ-ಬೇಸ್, ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತ. ಮತ್ತು ಸಂಕೀರ್ಣ. ಸೂಚಕಗಳು, ಅದರ ಗುಣಲಕ್ಷಣಗಳು (ಆಮ್ಲ ವಿಘಟನೆ ಸ್ಥಿರಾಂಕಗಳು, ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತ ವಿಭವಗಳು ಮತ್ತು ಲೋಹದ ಕ್ಯಾಟಯಾನುಗಳೊಂದಿಗೆ ಸಂಕೀರ್ಣಗಳ ಸ್ಥಿರತೆ ಸ್ಥಿರತೆಗಳು) ಆಡ್ಸರ್ಬಿರ್ನಲ್ಲಿ. ಸ್ಥಿತಿಯು ಕೆಸರಿನ ಮೇಲ್ಮೈಯಲ್ಲಿರುವ ಅಯಾನುಗಳ ಸ್ವರೂಪ ಮತ್ತು ಸಾಂದ್ರತೆಯನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ.
ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತ ಸೂಚಕಗಳು - ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತವನ್ನು ಅವಲಂಬಿಸಿ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸುವ ವಸ್ತುಗಳು. ಪರಿಹಾರ ಸಾಮರ್ಥ್ಯ. ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತ ತಾಪಮಾನವನ್ನು ಸ್ಥಾಪಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ. ಟೈಟರೇಶನ್ ಮತ್ತು ಕಲರ್ಮೆಟ್ರಿಕ್ಗಾಗಿ ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತದ ನಿರ್ಣಯ. ಸಂಭಾವ್ಯ (ಪ್ರಾಥಮಿಕವಾಗಿ ಜೀವಶಾಸ್ತ್ರದಲ್ಲಿ). ಅಂತಹ ಸೂಚಕಗಳು ನಿಯಮದಂತೆ, ಆಕ್ಸಿಡೀಕರಣ ಅಥವಾ ಕಡಿತಕ್ಕೆ ಒಳಗಾಗುವ ವಸ್ತುಗಳು, ಮತ್ತು ಆಕ್ಸಿಡೀಕೃತ (ಆಕ್ಸ್ನಲ್ಲಿ) ಮತ್ತು ಕಡಿಮೆಯಾದ (ಕೆಂಪು ಬಣ್ಣದಲ್ಲಿ) ರೂಪಗಳು ವಿಭಿನ್ನ ಬಣ್ಣಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ.
ರಿವರ್ಸಿಬಲ್ ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತಕ್ಕಾಗಿ. ಸೂಚಕಗಳನ್ನು ಬರೆಯಬಹುದು: Ox + ne ನಲ್ಲಿಡಿ ಕೆಂಪು ಬಣ್ಣದಲ್ಲಿ, ಇಲ್ಲಿ n ಎಂಬುದು ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಸಂಖ್ಯೆ. ಸಂಭಾವ್ಯ E ನಲ್ಲಿ, ಸೂಚಕದ ಎರಡೂ ರೂಪಗಳ ಸಾಂದ್ರತೆಯ ಅನುಪಾತವನ್ನು ನೆರ್ನ್ಸ್ಟ್ ಸಮೀಕರಣದಿಂದ ನಿರ್ಧರಿಸಲಾಗುತ್ತದೆ:
![]() ,
,
ಅಲ್ಲಿ E ln - ನಿಜವಾದ ಆಕ್ಸಿಡೀಕರಣ-ಕಡಿತ. ಸೂಚಕ ಸಂಭಾವ್ಯ, ಪರಿಹಾರದ ಸಂಯೋಜನೆಯನ್ನು ಅವಲಂಬಿಸಿ. ಅನುಪಾತ / 0.1 ರಿಂದ 10 ಕ್ಕೆ ಬದಲಾದಾಗ ಬಣ್ಣ ಪರಿವರ್ತನೆಯ ಮಧ್ಯಂತರವನ್ನು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಗಮನಿಸಬಹುದು, ಇದು 25 ° C ನಲ್ಲಿ ಅನುರೂಪವಾಗಿದೆ D E (V ನಲ್ಲಿ) = E ln b (0.059/n) ತೀಕ್ಷ್ಣವಾದ ಬಣ್ಣ ಬದಲಾವಣೆಗೆ ಅನುಗುಣವಾದ ಸಂಭಾವ್ಯತೆಯು ಎಲ್ನ್ಗೆ ಸಮಾನವಾಗಿರುತ್ತದೆ. ಸೂಚಕವನ್ನು ಆಯ್ಕೆಮಾಡುವಾಗ, ch ಅನ್ನು ಗಣನೆಗೆ ತೆಗೆದುಕೊಳ್ಳಿ. ಅರ್. ಮೌಲ್ಯಗಳು ಎಲ್ನ್, ಗುಣಾಂಕ. ಸೂಚಕದ ಎರಡೂ ರೂಪಗಳ ಮೋಲಾರ್ ಅಳಿವು ಮತ್ತು ಸಮಾನತೆಯ ಹಂತದಲ್ಲಿ ಪರಿಹಾರದ ಸಂಭಾವ್ಯತೆ. ಬಲವಾದ ಆಕ್ಸಿಡೈಸಿಂಗ್ ಏಜೆಂಟ್ಗಳೊಂದಿಗೆ ಟೈಟ್ರೇಟ್ ಮಾಡುವಾಗ (K 2 Cr 2 O 7, KMnO 4, ಇತ್ಯಾದಿ.), ತುಲನಾತ್ಮಕವಾಗಿ ಹೆಚ್ಚಿನ ಎಲ್ನ್ ಹೊಂದಿರುವ ಸೂಚಕಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ, ಉದಾಹರಣೆಗೆ, ಡಿಫೆನಿಲಾಮೈನ್ ಮತ್ತು ಅದರ ಉತ್ಪನ್ನಗಳು; ಬಲವಾದ ಕಡಿಮೆಗೊಳಿಸುವ ಏಜೆಂಟ್ಗಳೊಂದಿಗೆ ಟೈಟ್ರೇಟ್ ಮಾಡುವಾಗ [ಲವಣಗಳು Ti (III), V (II), ಇತ್ಯಾದಿ], ತುಲನಾತ್ಮಕವಾಗಿ ಕಡಿಮೆ ಎಲ್ನ್ ಹೊಂದಿರುವ ಸೂಚಕಗಳನ್ನು ಬಳಸಲಾಗುತ್ತದೆ, ಉದಾಹರಣೆಗೆ, ಸಫ್ರಾನಿನ್, ಮೀಥಿಲೀನ್ ನೀಲಿ (ಕೋಷ್ಟಕ 5).

ಕೆಲವು ವಸ್ತುಗಳು ತಮ್ಮ ಬಣ್ಣವನ್ನು ಬದಲಾಯಿಸಲಾಗದಂತೆ ಬದಲಾಯಿಸುತ್ತವೆ, ಉದಾಹರಣೆಗೆ, ಆಕ್ಸಿಡೀಕರಣದ ಸಮಯದಲ್ಲಿ ಅವು ಬಣ್ಣರಹಿತ ರಚನೆಯೊಂದಿಗೆ ನಾಶವಾಗುತ್ತವೆ. ಹೈಪೋಕ್ಲೋರೈಟ್ಗಳ ಪ್ರಭಾವದ ಅಡಿಯಲ್ಲಿ ಇಂಡಿಗೋ ಅಥವಾ BrO 3 ಅಯಾನುಗಳ ಪ್ರಭಾವದ ಅಡಿಯಲ್ಲಿ ನ್ಯಾಫ್ಥಾಲ್ ನೀಲಿ-ಕಪ್ಪು ಮುಂತಾದ ಉತ್ಪನ್ನಗಳು.
ಕಾಂಪ್ಲೆಕ್ಸೊಮೆಟ್ರಿಕ್ ಸೂಚಕಗಳು ಲೋಹದ ಅಯಾನುಗಳೊಂದಿಗೆ (M) ಬಣ್ಣದ ಸಂಕೀರ್ಣಗಳನ್ನು ರೂಪಿಸುವ ಪದಾರ್ಥಗಳಾಗಿವೆ, ಅವು ಸಂಕೀರ್ಣಮಾಪನದಲ್ಲಿ ಸಂಕೀರ್ಣ ಸೂಚಕಗಳನ್ನು ಸ್ಥಾಪಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ. ಸೂಚಕಗಳೊಂದಿಗೆ ಲೋಹದ ಸಂಕೀರ್ಣಗಳ ಸ್ಥಿರತೆ (ಇನ್) ಅನುಗುಣವಾದ ಸಂಕೀರ್ಣಗಳಿಗಿಂತ ಕಡಿಮೆಯಾಗಿದೆ,
ಆದ್ದರಿಂದ, ಸಂಕೀರ್ಣಗಳಲ್ಲಿ, ಸಂಕೀರ್ಣಗಳು ಲೋಹಗಳೊಂದಿಗೆ ಸಂಕೀರ್ಣಗಳಿಂದ ಸೂಚಕಗಳನ್ನು ಸ್ಥಳಾಂತರಿಸುತ್ತವೆ. ಸಮಾನತೆಯ ಹಂತದಲ್ಲಿ ಬಣ್ಣ ಬದಲಾವಣೆಯ ಕ್ಷಣದಲ್ಲಿ = ಮತ್ತು, ಆದ್ದರಿಂದ, рМ = - ಲಾಗ್ K Mln, ಅಲ್ಲಿ рМ = - ಲಾಗ್[M] ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಸೂಚಕದ ಪರಿವರ್ತನೆಯ ಬಿಂದು, K Mln - ಸೂಚಕದೊಂದಿಗೆ ಲೋಹದ ಸಂಕೀರ್ಣದ ಸ್ಥಿರತೆಯ ಸ್ಥಿರತೆ. ಟೈಟರೇಶನ್ ಸಮಯದಲ್ಲಿ ದೋಷವು ಒಂದು ನಿರ್ದಿಷ್ಟ ಮೊತ್ತದ ಕಾರಣದಿಂದಾಗಿರುತ್ತದೆ